肺癌可以分为两大类,非小细胞肺癌和小细胞肺癌。小细胞肺癌是肺癌中恶性程度最高的一种类型,具有进展快、转移早、易复发等特点。小细胞肺癌占肺癌总数的15%左右,大部分的小细胞肺癌患者(70%)为广泛期小细胞肺癌(ES-SCLC)。目前,还没有治疗ES-SCLC的有效疗法能够带来具有临床意义生存益处。
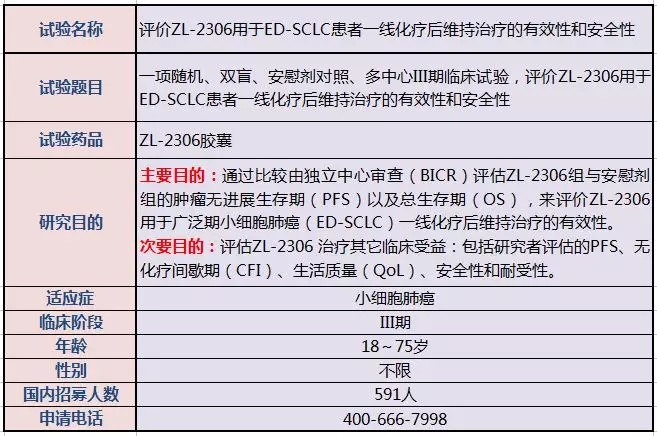
全国各中心正在开展一项Ⅲ期临床研究,评价ZL-2306用于广泛期小细胞肺癌(ED-SCLC)患者一线化疗后维持治疗的有效性和安全性。本次临床招募已经在中国国家食品药品监督管理总局登记注册,注册登记号为CTR20180888。依照临床实施方案规定,入选患者将被随机分配至实验组服用“ZL-2306”,或者分配至安慰剂组。
以下是该临床试验的相关信息,有意向的癌症患者可以联系全球肿瘤医生网的医学顾问。
入选标准
1 在进行任何研究有关的程序之前,签署书面知情同意书2 经组织学或细胞学证实的小细胞肺癌(不包括单独的痰液细胞学检查)3 在初次确诊时为广泛期病变:采用AJCC TNM 分期方法与 VALG 二期分期法相结合:AJCC IV期(任何 T,任何 N, M1a/b),或者 T3-4 由于肺部多发结节或者肿瘤/结节体积太大而不能被包含在一个可耐受放疗计划中4 年龄在18-75岁5 ECOG身体状态评分为 0或16 患者必须已经接受过4个疗程的含铂一线治疗,且必须在完成化疗后目前正处于完全缓解(CR)或部分缓解(PR)。可接受的联合化疗方案为依托泊苷+顺铂(EP)方案或依托泊苷+卡铂(EC)方案,期间顺铂或卡铂可以相互替换7 接受过PCI的患者在化疗最后一剂后≥3周且≤9周需进行随机分组,未接受过PCI的患者在化疗最后一剂后≥3周且≤5周需进行随机分组8 良好的器官功能,包括:1) 中性粒细胞计数 ≥ 1.5×109/L;2) 血小板 ≥ 100×109/L;3) 血红蛋白 ≥ 100 g/L;4) 血清肌酐 ≤ 1.5倍正常值上限(ULN),或肌酐清除率≥ 60 mL/min(按照Cockcroft-Gault公式计算);5) 总胆红素 ≤ 1.5倍ULN或直接胆红素 ≤ 1.0倍ULN;6) AST及ALT≤ 2.5倍ULN,肝转移时必须 ≤5倍ULN;7) 左心室射血分数(LVEF)≥50%9 育龄期女性患者入组时妊娠检查结果为阴性,且承诺从研究开始到研究结束期间以及最后一次给予研究用药后3个月内采取充分有效的避孕措施或节育的育龄期女性可入组本研究。或者入组本研究的妇女为无潜在生育能力的妇女,定义为:1) 接受外科结育手术(子宫切除术、双侧卵巢切除术或双侧输卵管切除术) 的妇女,或;2) ≥60 周岁的女性,或;3) ≥40 且<60 周岁、停经12个月以上10 能很好地依从方案,愿意按方案要求接受治疗和随访
排除标准
1 与原发疾病相关的情况:1) MRI检查确认有中枢神经系统转移;2) 化疗最后一剂后接受过胸部放射治疗;3) 不能用适当的干预措施控制的胸腔积液;4) 入组前3周内接受过 >20%骨髓的姑息性放疗2 患者在研究药物开始治疗前的4周内接受过血小板或红细胞输注3 任何既往的化疗的毒副反应未恢复至≤CTCAE 1级或基线水平,除外≤CTCAE 2级的症状稳定的感觉神经病变或脱发4 研究开始前3周接受过重大手术,或手术后尚未恢复的任何手术效应5 入组前5年内患有除小细胞肺癌以外的其它恶性肿瘤(除外已根治性治疗的原位宫颈癌、基底细胞癌、浅表膀胱肿瘤)6 正在接受或需要持续接受抗凝治疗或抗血小板治疗的患者7 患者有既往或当前诊断的骨髓增生异常综合征(MDS)或急性髓性白血病(AML)8 患有严重的或者未能控制的疾病,包括但不限于:1) 难以控制的恶心和呕吐、无法吞咽研究药物、任何可能干扰影响药物吸收代谢的胃肠道疾病;2) 活动性病毒感染如人类免疫缺陷病毒HIV、乙型肝炎HBV(Hbs Ag阳性或Hbs Ag阴性Hbc Ab阳性)、丙型肝炎HCV等;3) 未能控制的室性心率失常、最近3个月内发生过心肌梗塞;4) 未能控制的癫痫大发作、不稳定性脊髓压迫、未能控制的上腔静脉综合征;5) 免疫缺陷(除外脾切除)、或其它研究者认为有可能使患者暴露于高风险毒性的疾病;6) 痴呆症,精神状态改变,或任何精神疾病,不能提供知情同意或完成问卷调查9 校正QT间期(QTc)>470 毫秒;如果患者存在QTc间期延长,但研究者评估延长的原因为心脏起搏器(且无心脏其他异常),需要与申办方讨论后决定患者是否适合入组研究10 已知对ZL-2306或与ZL-2306具有相似化学结构药物的活性或非活性成分过敏者11 既往接受过PARP抑制剂治疗者12 受试者正在参加其他临床研究或距离前一项临床研究结束时间不足 1 个月13 怀孕或哺乳、或预期在研究治疗期间计划怀孕的患者14 任何可能干扰研究结果、影响患者全程参与研究的既往或当前的疾病、治疗、或实验室异常,或研究者认为患者不适合参与本研究
参加试验机构信息
|
序号 |
机构名称 |
研究者 |
|
1 |
上海市胸科医院 |
陆舜 |
|
2 |
上海市胸科医院 |
姜丽岩 |
|
3 |
浙江大学附属第一医院 |
周建英 |
|
4 |
浙江大学医学院附属第二医院 |
王凯 |
|
5 |
上海交通大学医学院附属瑞金医院 |
高蓓莉 |
|
6 |
南京军区南京总医院 |
宋勇 |
|
7 |
南通市肿瘤医院 |
张晓东 |
|
8 |
华中科技大学同济医学院附属协和医院 |
董晓荣 |
|
9 |
湖南省肿瘤医院 |
杨农 |
|
10 |
安徽省立医院 |
潘跃银 |
|
11 |
中国医学科学院肿瘤医院 |
李峻岭 |
|
12 |
辽宁省肿瘤医院 |
李晓玲 |
|
13 |
锦州市中心医院 |
王嵬 |
|
14 |
吉林大学第一医院 |
崔久嵬 |
|
15 |
北京307医院 |
刘晓晴 |
|
16 |
首都医科大学附属北京胸科医院 |
刘喆 |
|
17 |
广州医科大学第一附属医院 |
何建行 |
|
18 |
南方医院 |
廖旺军 |
|
19 |
哈尔滨医科大学附属肿瘤医院 |
陈公琰 |
|
20 |
郑州大学附属第一医院 |
李醒亚 |
|
21 |
中南大学湘雅二医院 |
胡春宏 |
|
22 |
南昌大学第一附属医院 |
熊建萍 |
|
23 |
南昌大学第二附属医院 |
刘安文 |
|
24 |
沈阳市胸科医院 |
李茵茵 |
|
25 |
福建省肿瘤医院 |
黄诚 |
|
26 |
浙江省肿瘤医院 |
张沂平 |
|
27 |
北京协和医院 |
王孟昭 |
|
28 |
北京肿瘤医院 |
赵军 |
|
29 |
唐都医院 |
张贺龙 |
|
30 |
河南省肿瘤医院 |
马智勇 |
|
31 |
新疆维吾尔自治区肿瘤医院 |
刘春琳 |
|
32 |
河北医科大学第四医院 |
丁翠敏 |
|
33 |
广西医科大学第一附属医院 |
胡晓桦 |
|
34 |
临沂市肿瘤医院 |
石建华 |












































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城