2020年全球一代免疫治疗法,肿瘤免疫治疗药物,癌症PD-1药物,PD-L1药物百花齐放
免疫疗法是攻克癌症的希望,通过激活人体自身的免疫系统攻击癌症的方式已被证实可以用于所有的实体肿瘤,其中,PD-1/PD-L1免疫疗法(immunotherapy)无疑是最大赢家,这种旨在充分利用人体自身的免疫系统抵御、抗击癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡的抗癌新方式,已经先后斩获了包括肺癌,胃肠道肿瘤,乳腺癌,泌尿系统肿瘤,皮肤癌,淋巴瘤等在内的近20大实体肿瘤,实质性的改善了晚期肿瘤患者的生存期,成为肿瘤患者的“特效”药物,让医学界和病友们都切切实实的看到了免疫治疗时代给晚期肿瘤治疗带来的彻底变革!
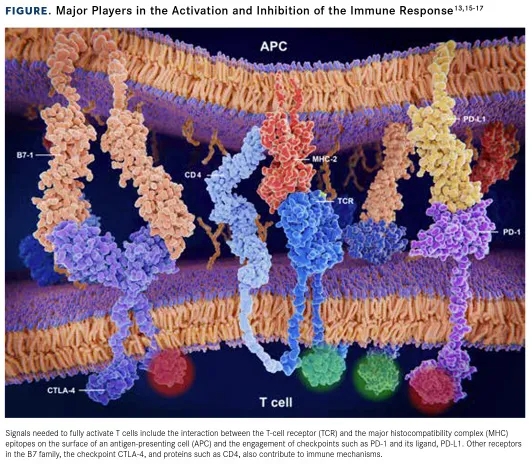
目前全球已经获批上市了十款PD-1/L1,除此之外,针对PD-1 / PD-L1途径的几十种新一代免疫检查点抑制剂正在火热开发中,见表一。
根据最近的一项分析,截至2019年9月,全球近3000项PD-1 / PD-L1抑制剂临床试验正在招募,超过50万患者登记。值得振奋的是,近两年,我国的生物技术公司在该领域也非常活跃。除了来自国际制药公司的药物外,中国监管机构还批准了4种在国内开发的PD-1抑制剂,还有4-8种和其他几种新疗法正在后期临床测试中。今天全球肿瘤医生网医学部就为大家进行全面的盘点。
全球十大上市的PD-1/L1信息汇总
目前全球共有十款PD-1/L1免疫检查点抑制剂获批,包括美国的六款和国产的四款,获批的适应症及基本用药信息总结如下,供大家参考。
美国上市的免疫治疗药物
1.Keytruda
药品名称:派姆单抗(pembrolizumab,Keytruda)
作用靶点:PD-1
生产厂家:默沙东
上市情况:国内上市获批
适应症:晚期非小细胞肺癌、晚期肾细胞癌、晚期头颈鳞状细胞癌、广泛期小细胞肺癌、晚期黑色素瘤、局部晚期或转移性尿路上皮癌、晚期默克尔细胞癌、晚期尿路上皮癌、浸润性膀胱癌、晚期胃癌或胃食管交界癌、晚期食管鳞状细胞癌、难治或复发性霍奇金淋巴瘤、纵膈大B细胞淋巴瘤、晚期MSI-H/dMMR实体瘤、晚期宫颈癌、晚期肝细胞癌
剂量和时间表:成人每周200毫克(静脉输注30分钟);小儿患者(患有cHL,PMBCL,MSI-H/dMMR癌症或MCC)2MG/KG,最高200MG
2.Opdivo
药品名称:纳武单抗(Nivolumab,Opdivo)作用靶点:PD-1
生产厂家:百时美施贵宝
上市情况:国内上市
获批适应症:
不可切除或转移性黑色素瘤、转移性非小细胞肺癌、晚期肾细胞癌、复发或进展的经典霍奇金淋巴瘤、头颈部复发或转移性鳞状细胞癌、局部晚期或转移性尿路上皮癌、黑色素瘤的辅助治疗、晚期肝细胞癌、MSI-H/dMMR转移性结直肠癌(适用于12岁及以上且体重40公斤或以上的成年和儿科患者)
剂量和时间表:每2周240毫克或每4周480毫克(静脉输注30分钟)
MSI-H/dMMR转移性结直肠癌(适用于12岁记上且体重不足40公斤的小儿科患者)
剂量和时间表:纳武单抗每2周3MG/KG
转移性小细胞肺癌
剂量和时间表:每2周纳武单抗240毫克
3.Tecentriq
药品名称:阿特珠单抗(atezolizumab,TECENTRIQ)
作用靶点:PD-L1
生产厂家:罗氏
上市情况:国内上市
获批适应症:
三阴乳腺癌
剂量和时间表:阿特珠单抗840MG,每2周静脉输注至少60分钟;当同一天联合化疗药使用时,在给化疗药前给予阿特珠单抗
局部晚期或转移性尿路上皮癌、广泛期小细胞肺癌
剂量和时间表:可以每2周以840MG,每3周以1200MG或每4周以1680MG的剂量给药
转移性非小细胞肺癌
剂量和时间表:阿特珠单抗1200MG,每3周静脉输注至少60分钟;当同一天联合化疗药使用时,在给化疗药前给予阿特珠单抗
4.Imfinzi
药品名称:德瓦鲁单抗(durvalumab,IMFINZI)作用靶点:PD-L1生产厂家:阿斯利康上市情况:国内上市
获批适应症:无法手术切除的III期非小细胞肺癌、广泛期小细胞肺癌、转移性尿路上皮癌
剂量和时间表:每2周10MG/KG
5.Bavencio
药品名称:阿维鲁单抗(avelumab,BAVENCIO)
作用靶点:PD-L1
生产厂家:辉瑞
上市情况:美国上市
获批适应症:转移性默克尔细胞癌、晚期肾细胞癌、转移性尿路上皮癌
剂量和时间表:每2周10MG/KG
6.Libtayo
药品名称:西米普利单抗(Cemiplimab,Libtayo)
作用靶点:PD-1
生产厂家:赛诺菲
上市情况:美国上市
获批适应症:转移性皮肤鳞状细胞癌
剂量和时间表:每3周350MG30分钟输注
中国上市的免疫治疗药物
1.拓益
药品名称:特瑞普利单抗(拓益)
作用靶点:PD-1
生产厂家:君实生物
适应症:黑色素瘤
2.达伯舒
药品名称:信迪利单抗(达伯舒)
作用靶点:PD-1
生产厂家:信达生物
适应症:经典霍奇金淋巴瘤
3.艾瑞卡
药品名称:卡瑞丽珠单抗(艾瑞卡)
作用靶点:PD-1
生产厂家:恒瑞医药
适应症:经典霍奇金淋巴瘤
4.百泽安
药品名称:替雷利珠单抗(百泽安)
作用靶点:PD-1
生产厂家:百济神州
适应症:1.经典霍奇金淋巴瘤 2.尿路上皮癌
美国新一代靶向PD-1/L1药物研发进展一览
01、完全缓解率44%!spartalizumab进军晚期黑色素瘤一线治疗
药品名称:斯巴达珠单抗(spartalizumab,PDR001)
生产厂家:诺华
适应症:转移性黑色素瘤
Spartalizumab(PDR001)是一种人源化单克隆抗体,针对人类免疫细胞表面程序性死亡受体1(PD-1),具有免疫检查点抑制和抗肿瘤活性。给药后,斯巴达珠单抗与活化的T细胞上表达的PD-1结合并阻断与其配体结合,阻止了PD-1介导的信号传导,并使T细胞活化产生对抗肿瘤细胞的免疫反应。
近期,诺华在ASCO会议上公布了III期研究COMBI-i的试验数据,入组初治BRAF V600突变不可切除性或转移性黑色素瘤患者,评估spartalizumab联合dabrafenib和trametinib 3药方案作为一线治疗相对于安慰剂+dabrafenib+trametinib方案的安全性和有效性。
36位患者的汇总数据显示,实验组客观缓解率(ORR)为78%,其中包括44%的完全缓解(CR)。中位随访24.3个月后仍未达到中位反应持续时间,2年总生存率为53.4%。中位无进展生存期(PFS)为22.7个月,中位总体生存期(OS)还未达到。
因此,spartalizumab + dabrafenib +曲美替尼三药联合使用能达到较高的客观缓解率和完全缓解率,并具有较高的持久反应频率,其中包括预后不良的患者。
COMB-i仍在继续进行一项随机研究,其中约500例先前未经治疗的可切除转移性患者BRAF V600突变的黑色素瘤将接受包括spartalizumab的三联疗法或两种靶向药物的双联疗法。
诺华计划提交3药方案治疗转移性BRAF V600+黑色素瘤上市申请。目前,spartalizumab正在II期研究评估治疗其他类型癌症,包括神经内分泌肿瘤、鼻咽癌、非小细胞肺癌、三阴性乳腺癌、肝细胞癌和结直肠癌。在美国,spartalizumab被授予治疗神经内分泌肿瘤的孤儿药资格。因此,这一新型的PD-1抗体也非常值得期待。
02、客观缓解率42%!dostarlimab助力晚期子宫内膜癌治疗
药品名称:多斯塔利马(dostarlimab,TSR-042)
生产厂家:葛兰素史克
适应症:子宫内膜癌
dostarlimab是一种研究性人源化抗PD-1单克隆抗体,与PD-1受体结合,并阻断其与配体PD-L1和PD-L2的相互作用。
GARNET是一项正在进行的I/IIB期研究,正在评估dostarlimab作为一种单药疗法治疗晚期实体瘤患者。其中,子宫内膜癌的分析数据近期在ASCO大会上公布,在入组的71名患者中,均为接受含铂化疗期间或化疗后病情进展的复发性或晚期错配修复缺陷(dMMR)子宫内膜癌患者,接受dostarlimab每3周一次(Q3W)500mg剂量治疗4剂,之后每6周一次(Q6W)1000mg,直至病情进展。
结果显示:dostarlimab治疗的ORR为42%、疾病控制率(DCR)为58%,其中,13%的患者病情完全缓解(CR),30%的患者病情部分缓解(PR)。
03、持续缓解率100%,cosibelimab或将上市
药品名称:科西贝利单抗(cosibelimab,CK-301)
生产厂家:Checkpoint Therapeutics
适应症:非小细胞肺癌,皮肤鳞状细胞癌
cosibelimab(CK-301)是一种针对PD-L1的完全人源单克隆抗体。在2019年欧洲分子肿瘤学会会议上公布了首次人类研究(NCT03212404)的积极中期数据,截止到2019年8月,有68位实体肿瘤患者接受了至少2次以上的治疗并失败,接受cosibelimab治疗的客观缓解率达到27.9%。其中皮肤鳞状细胞癌(CSCC;n = 14)和非小细胞肺癌(NSCLC;n = 25)患者队列的ORR分别高达50%和40%,持续缓解的患者分别为100%和90%。
基于FDA的积极反馈,或将根据此试验的数据将cosibelimab批准作为皮肤鳞状细胞的治疗药物。
04、无进展生存率高达85.7%!新一代双靶点广谱抗癌药M7824闪亮登场
药品名称:Bintrafusp alfa(M7824)
生产厂家:默克
适应症:非小细胞肺癌
Bintrafusp alfa,也就是大名鼎鼎的M7824,是德国默克公司研发的一种双功能抗体蛋白,意味着一个药物可以同时有两个靶点,能同时拮抗TGFβ与PD-L1,这样就会极大地提升药物的无进展生存率,并降低联合用药的副作用。它长这个样子:
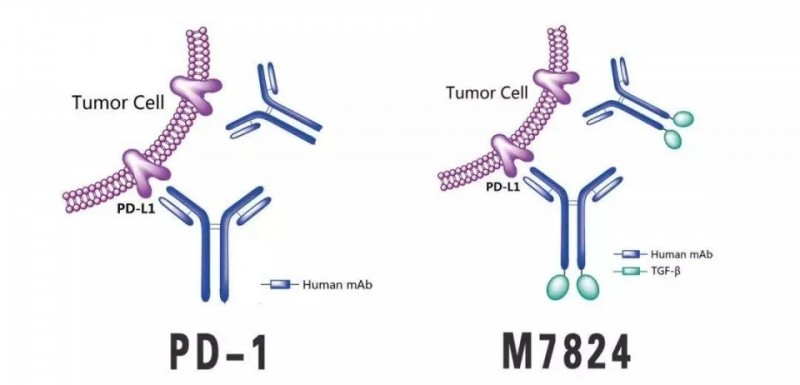
M7824是由人IgG 1组成的双功能蛋白抗PD-L1抗体通过接头与两个TGF-β受体II分子融合
M7824或可比作是第二代PD-1!这个药物在临床前动物实验的无进展生存率是100%,全部的试验动物都产生治疗应答!
在近日,胸部肿瘤学杂志(JTO)上公布的研究中,德国默克(Merck KGaA)的在研新药M7824公布的临床数据引起轰动!
结果显示,在非小细胞肺癌患者群体中,这款创新疗法取得了卓越的临床效果——在PD-L1阳性患者群体(PD-L1不小于1%)中,该新药的总体缓解率(ORR)达到了37%。而在PD-L1高表达的患者群体(肿瘤细胞PD-L1表达≥80%中,M7824的客观缓解率(ORR)更是高达85.7%!原文链接:无进展生存率高达85.7%!新一代双靶点广谱抗癌药M7824闪亮登场

2020年6月刚刚举行的ASCO虚拟大会更新了研究的随访数据。
M7824二线治疗的中位持续缓解时间为18个月,18个月和24个月的无进展生存率分别为18.4%和11%。18个月和24个月的总生存率为49.7%和39.7%。18个月和24个月的缓解率分别为42.4%和21.2%。
PD-L1 ≥1%的患者中位总生存期为21.7个月。7例PD-L1≥50%的患者中6例依然存活。
一项实验正在进行针对pembrolizumab的头对头试验,争夺PD-L1阳性NSCLC(NCT03631706)一线治疗的宝座。
同时,在最近的各种会议上都报告了正在进行的Bintrafusp alfa各项实体瘤研究:
三阴乳腺癌:在33例严重重度三阴性乳腺癌患者中,有1例确诊为CR,2例为部分缓解(PR),中位PFS和OS分别为1.3个月和7.8个月。
宫颈癌:25例患者中,报告了6例确定反应(ORR,24%);
晚期非小细胞肺癌:在80名接受过化学疗法但未接受免疫治疗的患者中,bintrafusp alfa疗法在整个人群中的ORR率为21.3%。
临床试验目前仍在美国,英国,加拿大,澳大利亚,欧洲,韩国,台湾和日本招收患者。以上临床试验详细信息可自行在https://clinicaltrials.gov/查询,也可登录全球肿瘤医生网医学部咨询,.
中国新一代靶向PD-1/L1药物研发进展一览
以往,抗癌药进入国内至少需要3~5年的时间,而近两年,随着政府的重视,我国加快了抗癌药入市的步伐,至此,国内已有8款免疫检查点抑制剂上市,包括4款国产PD-1,2款进口PD-1和2款进口的PD-L1。
O药(进口):Opdivo(Nivolumab)、
K药(进口):Keytruda(Pembrolizumab)、
T药(进口):Tecentriq(Atezolizumab)、
I药(进口):Imfinzi(Durvalumab)、
拓益:特瑞普利单抗
达伯舒:信迪利单抗
艾立妥:卡瑞丽珠单抗
百泽安:替雷利珠单抗
图片5
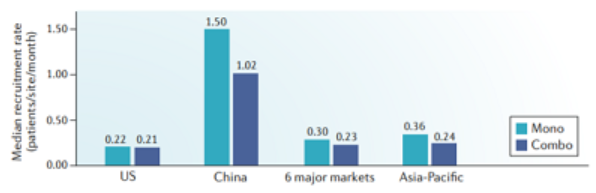
中国的患者终于迎来了真正的免疫治疗元年!更值得振奋的是,国产药企紧跟国际步伐,加速推进 PD-1/ PD-L1 的临床开发和上市进程,众多PD-1数据惊艳,有望上市。并且根据Nature上一项新的研究报告,中国PD-1/L1的临床招募率是全球最高的。
01、全球首个可皮下注射的PD-L1抑制剂-KN035来了
药品名称:Envafolimab(KN035)
生产厂家:康宁杰瑞
适应症:MSI-H / dMMR癌症目前,市场上的PD-(L)1治疗需要频繁进行静脉注射,既不能满足患者用药的便捷性需求,也将影响患者使用药物的依从性。现在越来越多的癌症患者期待更加便捷的PD-(L)1疗法,KN035是康宁杰瑞自主研发的PD-L1单域抗体Fc融合蛋白,有望成为全球首个可皮下注射的PD-L1抑制剂,患者不需要进行静脉注射就可以轻松完成给药过程,大大缩短了给药时间(以秒为单位),并且具有居家自主给药的潜力,从而更好地改善患者的生活质量。KN035已被美国FDA授予晚期胆管癌孤儿药资格,2020年进行国内药品注册申报。
在今年的ASCO大会上,北京大学肿瘤医院公布了一项开放标签的II期研究结果,评估了KN035在晚期微卫星不稳定性高/错配修复缺陷(MSI-H / dMMR)癌症患者中的安全性和抗肿瘤活性。
截至2019年12月17日,中国25个中心招募了103名MSI-H / dMMR晚期癌症患者。主要疗效人群包括39例既往至少接受过含氟尿嘧啶类、奥沙利铂和伊立替康方案治疗的晚期结直肠癌患者和11例至少接受过一线标准治疗胃癌患者,中位随访时间为7.5个月。总体人群包括65例CRC患者(24例先前接受过F和O或I治疗),18例接受GC和20例接受其他肿瘤治疗,中位随访时间为6.7个月。
结果显示:
1.主要疗效人群中经确认的客观缓解率为30%,80%患者在数据截止时持续缓解;
2.先前接受氟尿嘧啶和奥沙利铂或伊立替康治疗的CRC患者中为54.2%;
3.总体人群经确认的客观缓解率为34.0%,85.7%患者在数据截止时持续缓解。
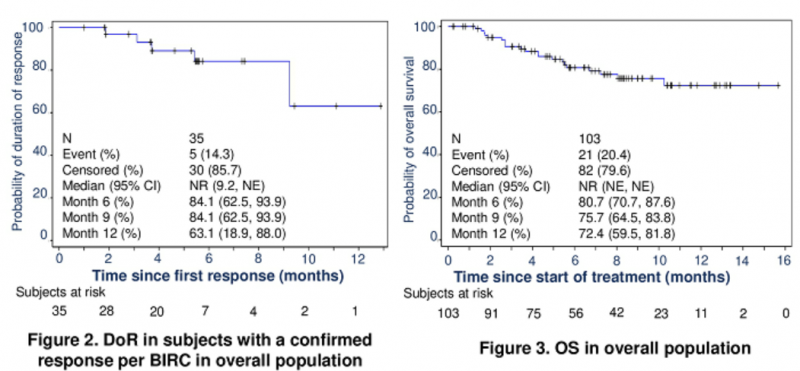
由此可以看出,Envafolimab(KN035)在先前接受治疗的晚期MSI-H / dMMR癌症患者中显示出持久的抗肿瘤活性,并具有可控的安全性。有望成为全球首个上市的通过皮下注射给药的PD-1/PD-L1抗体。
02、疾病控制率84%!AK-105未来可期
药品名称:Penpulimab(AK105)
生产厂家:正大天晴
适应症:肝癌
在2020年美国临床肿瘤学会(ASCO)上,Penpulimab以壁报形式公布了 联合抗肿瘤血管生成药物安罗替尼一线治疗晚期肝细胞癌的临床疗效和安全性数据,DCR达84%,未来可期!在Ib/II期研究中,入组31例患者均接受penpulimab(200mg Q3W)联合盐酸安罗替尼(8mg, qd,连续2周停1周)。
结果显示:
客观缓解率(ORR):24%(6/25)疾病控制率(DCR):84%(21/25)
penpulimab联合安罗替尼一线治疗不可切除的肝细胞癌患者初步显示出令人鼓舞的的疗效和良好的安全性,值得期待进一步的临床数据。
癌症患者的春天已在路上
希望免疫治疗能够取得更加辉煌的战绩,也希望我们国产的抗癌药能尽快赶超美国,有更多价格亲民的抗癌好药造福更多的患者。
想了解更多药物和临床试验信息可以拨打客服电话()或者在线咨询。








































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城