CAR-T疗法,CAR-T技术、CAR-T细胞免疫疗法有哪些,CAR-T治疗价格、费用、多少钱,新的CAR-T临床试验招募信息汇总
不知道大家有没有和小汇一样的感觉,这几年的抗癌新技术发展真的很快。
硼中子俘获疗法的概念从提出至今已有数十年,但直到去年才在患者中真正爆红,成为热点;被誉为“生物导弹”的抗体-药物偶联物(ADC)在去年终于正式进入中国,拉开了国内靶向药物“升级”的序幕;CAR-T细胞疗法的研究同样历经多年,但从去年、尤其是从去年下半年至今,大量CAR-T疗法“扎堆”问世,抗癌“新势力”正在迅速崛起……
首位使用CAR-T疗法治疗的白血病患儿、CAR-T疗法的“代言人”艾米丽(Emily Whitehead)战胜白血病已经有近十年,如今这种为她创造“奇迹”的疗法,终于走到了我们的患者身边。
关键词①:"上市"
从2021年至今,CAR-T疗法展现出了厚积薄发之势,多款产品接连上市。就在这期间,我国先后迎来了3款CAR-T疗法上市,让中国患者看到了新方案的曙光。
Liso-Cel
(Lisocabtagene maraleucel,Breyanzi)
状态:批准上市(FDA)
时间:2021年2月6日
简介:Liso-Cel是一款基于患者自身T细胞的抗CD19疗法。
适应症:大B细胞淋巴瘤(部分类型的大B细胞淋巴瘤成年患者,这些患者在接受至少2种其它类型的全身治疗方案无反应或在治疗后复发)
相关临床试验及数据:
【TRANSCEND NHL 001试验(NCT02631044)】接受Liso-Cel治疗的患者,整体缓解率为73%,其中完全缓解率高达53%;患者约在接受治疗1个月后可以达到首次缓解或部分缓解。
中位随访12个月时,仍有54.7%的患者保持临床缓解;患者的中位无进展生存期为6.8个月,中位总生存期为21.1个月;患者的1年生存率为58%。
Axi-Cel
(Axicabtagene ciloleucel,Yescarta)
状态:批准上市(FDA)
时间:2021年3月5日
简介:Yescarta是一款CAR-CD19 T细胞疗法,曾经在滤泡性淋巴瘤适应症上获得FDA授予的突破性疗法指定和优先审查资格。此前,FDA曾经批准过Yescarta的大B细胞淋巴瘤适应症。此次获批后,Yescarta成为了滤泡性淋巴瘤的首款CAR-T细胞免疫疗法。
适应症:滤泡性淋巴瘤(复发或难治性滤泡性淋巴瘤,成年患者,经过两次或以上全身治疗)
相关临床试验及数据:
【ZUMA-5试验】整体缓解率达到了91%,完全缓解率高达60%;中位随访14.5个月时尚未达到中位缓解持续时间,74%的患者缓解持续时间超过18个月。
状态:批准上市(FDA,补充生物制剂许可)
适应症:复发/难治性B细胞淋巴瘤成年患者的二线治疗大剂量方案
Ide-cel
(Idecabtagene vicleucel,Abecma)
状态:批准上市(FDA)
时间:2021年3月26日
简介:Abecma是一款BCMA导向的自体嵌合抗原受体(CAR)T细胞疗法,由患者自体T细胞定制而成。
适应症:多发性骨髓瘤(复发或难治性多发性骨髓瘤成年患者,曾接受过4线或更多方案治疗,包括免疫调节剂、蛋白酶体抑制剂和CD38单抗)
相关临床试验及数据:
【多中心研究】所有患者整体缓解率72%,其中完全缓解率28%;在达到了临床完全缓解的患者中,65%的患者缓解持续了超过12个月。
KTE-X19
(Brexucabtagene Autoleucel,Tecartus)
状态:批准上市(FDA)
时间:2021年10月1日
简介:一款CAR-CD19 T细胞疗法,此前曾获批用于治疗套细胞淋巴瘤。
适应症:B淋巴细胞白血病(复发及难治性B淋巴细胞白血病成年患者)
相关临床试验及数据:
【ZUMA-3试验】完全缓解率56.4%,此外还有14.5%的患者达到了临床完全缓解,仅血细胞计数未完全恢复正常,即达到了CRi;中位无进展生存期11.6个月,中位总生存期18.2个月。达到了临床完全缓解(包括血细胞计数没有恢复正常)的患者,中位无进展生存期为14.2个月,总生存期最短也有16.2个月;而未达到的患者,中位总生存期仅有2.4个月。
益基利仑赛注射液
(阿基仑赛;Yescarta,Axicabtagene Ciloleucel,Axi-Cel;FKC876)
状态:批准上市(NMPA)
时间:2021年6月23日
价格:120万人民币/针
简介:首款在中国上市的CAR-T细胞产品,为CAR-CD19-T细胞疗法。
适应症:大B细胞淋巴瘤(接受过二线或以上标准治疗后复发或难治性大B细胞淋巴瘤成年患者,包括弥漫性大B细胞淋巴瘤非特指型、原发性纵隔B细胞癌淋巴瘤、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的弥漫性大B细胞淋巴瘤)
相关临床试验及数据:
【ZUMA-5试验】整体缓解率达到了91%,完全缓解率高达60%;中位随访14.5个月时尚未达到中位缓解持续时间,74%的患者缓解持续时间超过18个月。
瑞基奥仑赛注射液
(Relma-cel,JWCAR029)
状态:批准上市(NMPA)
时间:2021年9月3日
价格:129万人民币/针
简介:第二款在中国上市的CAR-T细胞产品,同时也是首款正式获批上市的国产CAR-CD19-T疗法,由上海药明巨诺研发。
适应症:大B细胞淋巴瘤(经过二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成年患者)
相关临床试验及数据:
整体缓解率为60.3%。
西达基奥仑赛注射液
(LCAR-B38M,JNJ-4528,Cilta-cel,Carvykti)
状态:批准上市(NMPA)
时间:2022年2月28日
价格:46.5万美元/针(约合人民币294万元)
简介:第三款在中国上市的CAR-T细胞产品,是一款由杨森公司(Janssen)和传奇生物合作开发的CAR-BCMA-T疗法。
适应症:多发性骨髓瘤(复发/难治性多发性骨髓瘤成人患者)
相关临床试验及数据:
【CARTITUDE-1试验】整体缓解率98%,其中83%的患者达到严格的完全缓解;患者18个月无进展生存率66%,2年无进展生存率61%;18个月总生存率81%,2年总生存率74%。
关键词②:"资格"
除了上面几款已经上市的产品,还有更多的CAR-T细胞产品正处于上市前的阶段,逐步积累临床试验数据,或者已经提交了上市申请,距离正式与患者见面只差临门一脚。
它们当中,有许多潜力不亚于上市产品的“新秀”,在这段期间获得了FDA的各类许可或“头衔”,例如孤儿药称号、快速通道资格、再生免疫高级疗法等等。
Cilta-cel
(Ciltacabtagene autoleucel,国内名称:西达基奥仑赛注射液)
状态:(FDA)优先审查
适应症:多发性骨髓瘤(复发/难治性多发性骨髓瘤)
简介:CAR-BCMA-T细胞疗法
相关临床试验及数据:
【CARTITUDE-1试验】整体缓解率98%,其中83%的患者达到严格的完全缓解;患者18个月无进展生存率66%,2年无进展生存率61%;18个月总生存率81%,2年总生存率74%。
ALLO-715
状态:(FDA)RMAT称号,孤儿药称号
适应症:多发性骨髓瘤(复发/难治性多发性骨髓瘤)
简介:CAR-BCMA-T细胞疗法
相关临床试验及数据:
【UNIVERSAL试验】在接受了3.2×10^6(3.2亿)CAR-T细胞输注的患者中,整体缓解率达到了60%。患者中位治疗线数为5线。
Kymriah
(Tisagenlecleucel)
状态:(FDA)新适应症优先审查
适应症:滤泡性淋巴瘤(复发或难治性滤泡性淋巴瘤的二线以上治疗)
简介:CAR-CD19-T细胞疗法,曾获批用于复发/难治性大B细胞淋巴瘤成年患者
相关临床试验及数据:
【JULIET试验】613例患者整体缓解率为57.4%,其中42.4%的患者为完全缓解。
CTX110
状态:(FDA)RMAT称号
适应症:B细胞恶性肿瘤(复发或难治性CD19阳性B细胞恶性肿瘤)
简介:同种异体CAR-CD19-T细胞疗法
相关临床试验及数据:
【CARBON试验】在符合意向治疗标准的24例患者当中,第2个剂量组接受CTX110治疗的整体缓解率为58%,其中包括38%的患者达到了临床完全缓解。
CT120
状态:(FDA)孤儿药称号
适应症:急性淋巴细胞白血病
简介:CD19/CD22双靶向嵌合抗原受体(CAR)T细胞疗法
C-CAR039
状态:(FDA)RMAT称号,快速通道
适应症:弥漫性大B细胞淋巴瘤
简介:CD19/CD20双靶向嵌合抗原受体-T细胞疗法
相关临床试验及数据:
【Ⅰ期试验】复发或难治性弥漫性大B细胞淋巴瘤患者整体缓解率91.7%,其中完全缓解率83.3%。
CT103A
状态:(FDA)孤儿药称号
适应症:多发性骨髓瘤
简介:CAR-BCMA-T细胞疗法
相关临床试验及数据:
【Ⅰ期试验】在18例复发和/或难治性多发性骨髓瘤患者当中,CT103A的整体缓解率为100%,其中72.2%的患者达到了完全缓解的标准;1年无进展生存率58.3%。
Liso-Cel
(Lisocabtagene maraleucel,Breyanzi)
状态:(FDA)优先审查,已接受上市审批申请
简介:CAR-CD19-T细胞疗法
适应症:大B细胞淋巴瘤(前线治疗失败的复发或难治性大B细胞淋巴瘤成年患者)
关键词③:"实体瘤"
目前为止所有已经上市的CAR-T细胞疗法所针对的癌种都是各类血液系统肿瘤,即使将有希望上市的疗法计算在内,针对实体瘤的项目也寥寥无几。CAR-T疗法突破实体肿瘤的难度如此之大,只有少数的“精英”,才能在这个最困难的“战场”上。
CT041
状态:(FDA)RMAT称号,孤儿药称号
适应症:胃癌(Claudin18.2阳性的晚期胃癌及胃食管结合部腺癌)
简介:CAR-Claudin 18.2-T细胞疗法
相关临床试验及数据:
所有患者整体缓解率48.6%,疾病控制率73%;所有胃癌患者整体缓解率57.1%。.既往接受至少2线治疗失败的胃癌患者整体缓解率61.1%,疾病控制率83.3%。
毫无疑问,CT041是所有针对实体瘤的CAR-T细胞疗法当中进展最快、当前疗效最理想的方案之一。目前这一方案仍在招募受试者,有机会尝试的患者一定不要错过!
AIC100
状态:(FDA)快速通道
适应症:甲状腺癌(间变性甲状腺癌及难治性低分化甲状腺癌)
简介:CAR-ICAM-1-T细胞疗法
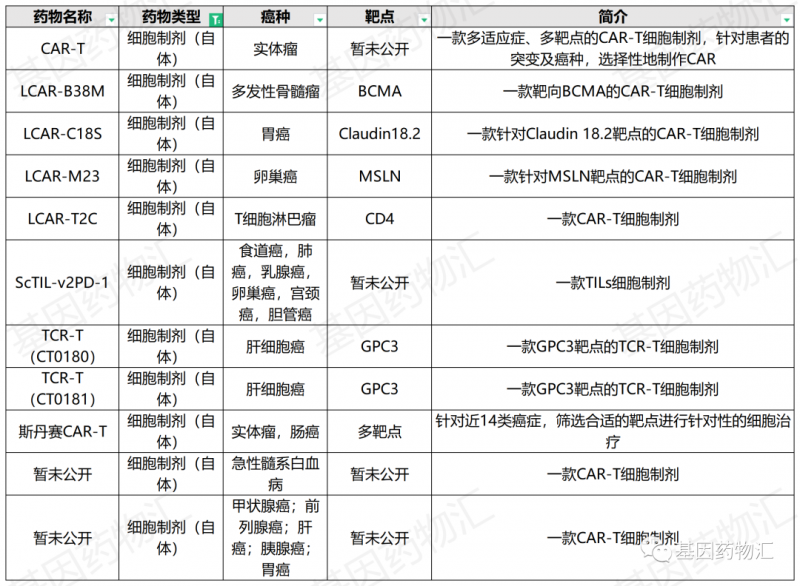
关键词④:"临床试验"
目前在中国上市的三款CAR-T产品,一款一针120万、一款一针129万、一款一针46.5万美元(约合人民币294万),对于绝大多数患者来说,都是一个比较难承受的价位。
CAR-T疗法的花费显然是不菲的,但同时,我国又是CAR-T细胞疗法研究及临床试验项目最多的国家,大量国内中心的试验项目正在招募中国患者。对于符合适应症需求的患者来说,这是一个提前享受新药治疗且避免巨额开销的好渠道。
希望尝试CAR-T疗法以及其它免疫细胞疗法的患者,可以在线咨询了解详情。








































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城