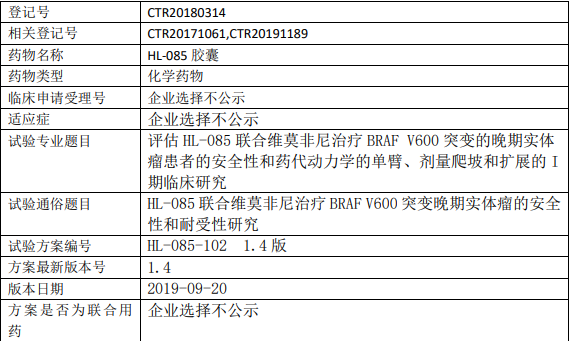
HL-085临床试验,HL-085胶囊联合维莫非尼治疗 BRAF V600 突变晚期实体瘤的安全性和耐受性研究
1、试验目的
为在 BRAF V600 突变的晚期实体瘤患者中进行的剂量爬坡和剂量扩展的 I 期临床研究,旨在确定 HL-085 联合维莫非尼治疗 BRAF V600 突变的晚期实体瘤患者的耐受性、安全性、药代动力学特征和初步抗肿瘤疗效。
2、试验设计
试验分类:安全性和有效性
试验分期:I 期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至 70 岁(最大年龄)
性别:男+女
健康受试者:无
入选标准
1.18-70 岁(含)男性或女性患者;
2.经标准治疗失败、或不能耐受标准治疗、或拒绝标准治疗、或尚无标准治疗的晚期实体瘤患者(Ib 研究阶段纳入Ⅲb-Ⅳ期NSCLC 患者);
3.基线时能够提供足够的组织学标本进行基因突变检测并确定为BRAF V600 突变(Ib 研究阶段要求提供足够的组织学标本进行基因突变检测并确定为 BRAF V600E 突变);
4.根据实体瘤疗效评价标准(RECIST v1.1 版)有可测量的病灶;
5.在研究药物给药治疗前,既往化疗、免疫疗法或放疗必须已完成至少 4 周,并且在研究药物给药前所有相关毒性反应(除脱发)均已得到恢复(恢复至≤1 级或基线水平);
6.研究治疗首次用药前至少 14 天内未接受任何大手术(基线肿瘤活检除外)或发生严重创伤;
7.ECOG 评分为 0-1 分;
8.预期寿命大于 3 个月;
9.能够口服药物;
10.开始给药前 7 天内进行的实验室检查确定:
●绝对中性粒细胞计数≥1.5×10^9/L;
●血小板计数≥100×109/L 或实验室正常值范围下限;
●血红蛋白≥9 g/dL;
●血清肌酐≤1.5×正常值上限(ULN)或Cockroft-Gault 公式计算的肌酐清除率>60 mL/分钟;
●?AST、ALT 和碱性磷酸酶(ALP)≤1.5×ULN;并发肝转移者,AST、ALT≤3.0×ULN 和 ALP ≤6.0×ULN;并发骨转移者,ALP 可以>1.5×ULN,但同时 AST 和 ALT 不可以>1.5×ULN,且在之前的 14 天内未接受过医学支持疗法;总胆红素≤1.5×ULN(对于 Gilbert 综合征患者,总胆红素≤3×ULN);
●白蛋白≥3g/dL;
●国际标准化比率(INR)或血浆凝血酶原时间(PT)≤1.5×ULN;
11.能够理解并自愿签署书面知情同意书,知情同意书必须在执行任何试验指定的程序前签署;
12.必须自愿并能完成研究程序和随访检查。
排除标准
1.存在 EGFR 突变和 ALK 融合;
2. 已知对研究药物成份或其类似物过敏的患者;
3. 既往曾接受过特异性 MEK 抑制剂和 BRAF 抑制剂的患者;
4. 研究给药开始前 4 周内,接受过其他任何研究治疗的患者;
5. 同时使用其他抗肿瘤药物伴随治疗(激素治疗可以接受);
6. 有活动性中枢神经系统(CNS)损伤(即,影像学不稳定、症状性损害)的患者应排除。注:对于接受立体定向脑部放疗或手术治疗的患者,在大于等于 3 个月期间脑部无疾病进展,则可以入选;
7. 正在接受并且不能在开始研究治疗前至少 1 周和研究期间停用方案禁止的影响 CYP 同工酶(CYP2C9 和 CYP2C19 的强诱导剂、强抑制剂)的静脉或口服药物的患者8. 开始研究治疗前 4 周内,出现国家癌症研究所不良事件通用术语标准(NCI CTCAE v5.0)中规定的 3 级出血症状;
9. 无法吞咽胶囊或难治性恶心和呕吐、吸收不良、体外胆汁分流、或任何可能会妨碍研究药物充分吸收的显著的小肠切除;
10. 筛选时 Bazetts 公式校正的 ECG QTcB≥480msec,或有先天性长 QT 综合征病史;
11. 研究给药前 6 个月内,出现以下任一情况:心肌梗塞、重度/不稳定型心绞痛、冠状动脉/外周动脉旁路移植术、症状性充血性心力衰竭、需要用药的严重心率失常、难以控制的高血压、脑血管意外事件、或短暂性脑缺血发作、或症状性肺栓塞;
12. 未得到控制的伴随疾病或感染性疾病;
13. 既往或目前有视网膜中央静脉阻塞(RVO)、视网膜色素上皮脱离(RPED)等视网膜疾病;
14. 人免疫缺陷病毒(HIV)抗体阳性、丙型肝炎病毒(HCV)抗体阳性且 HCV RNA 阳性、乙型肝炎病毒表面抗原(HBsAg)阳性、乙型肝炎病毒核心抗体(HBcAb)阳性且 HBV DNA 阳性;
15. 已知患有慢性肝病;
16. 同种异体骨髓移植或器官移植病史;
17. 间质性肺病或间质性肺炎,包括有临床意义的放射性肺炎(即影响日常生活活动或需要干预治疗)的患者;
18. 对于绝经前女性(绝经后女性必须已绝经至少 12 个月才能被认为无生育能力)血清妊娠检查结果为阳性或经研究者判断,在研究期间及研究药物最后一次给药后至少 30 天内,有望怀孕、哺乳或不愿采用有效避孕措施的育龄患者(包括男性患者的育龄女性配偶);
19. 可能增加参与研究和研究用药风险、或者可能会干扰研究结果解释的其他重度、急性、或慢性临床或精神疾病或实验室异常情况。
研究者信息
1、主要研究者信息
姓名:石远凯
学位:医学博士
职称:主任医师
单位名称:中国医学科学院肿瘤医院
2、各参加机构信息
| 序号 | 机构名称 | (主要)研究者 | 国家 | 省(州)-城市 |
| 1 | 中国医学科学院肿瘤医院 | 石远凯 | 中国 | 北京-北京 |
| 2 | 浙江大学附属第一医院 | 郑玉龙 | 中国 | 浙江-杭州 |
| 3 | 北京肿瘤医院 | 方健 | 中国 | 北京-北京 |
| 4 | 河南省肿瘤医院 | 罗素霞 | 中国 | 河南-郑州 |
| 5 | 复旦大学附属中山医院 | 刘天舒 | 中国 | 上海-上海 |
| 6 | 天津市肿瘤医院 | 黄鼎智 | 中国 | 天津市-天津市 |
| 7 | 湖南省肿瘤医院 | 陈建华 | 中国 | 湖南省-长沙市 |
| 8 | 青岛大学附属医院 | 曹玉/于洪升 | 中国 | 山东省-青岛市 |
| 9 | 浙江大学医学院附属第二医院 | 沈虹 | 中国 | 浙江省-杭州市 |
| 10 | 浙江省肿瘤医院 | 余新民 | 中国 | 浙江省-杭州市 |




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城