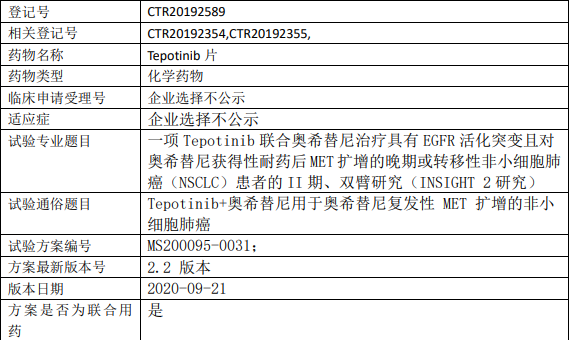
Tepotinib片(特泊替尼)临床试验,Tepotinib联合奥希替尼用于奥希替尼复发性MET扩增的非小细胞肺癌II期临床试验
1、试验目的
本研究旨在评估 tepotinib 联合奥希替尼以及 tepotinib 单药治疗在具有EGFR活化突变且经一线奥希替尼治疗后由于 MET 扩增而复发的晚期或转移性非小细胞肺癌患者中的抗肿瘤活性、安全性、耐受性和药代动力学特征。
2、试验设计
试验分类:安全性和有效性
试验分期:II 期
设计类型:平行分组
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
3、受试者信息
年龄:18 岁(最小年龄)至无岁(最大年龄)
性别:男+女
健康受试者:无
入选标准
1.局部晚期或转移性 NSCLC 组织学(通过组织学或细胞学证实),同时有记录的 EGFR 活化突变;
2.美国东部肿瘤协作组(ECOG)体能状态评分为 0 或 1,且最小预期寿命至少为 12 周;
3.对既往 EGFR-TKI 治疗具有获得性耐药性。受试者必须符合以下两个标准: 有既往 EGFR-TKI 治疗疾病进展的在既往奥希替尼治疗期间记录到客观临床获益(定义为部分或完全影像学缓解),或开始既往奥希替尼治疗后出现持久疾病稳定(SD)(SD 应持续>6个月)
4.仅接受过奥希替尼作为非根治性的针对晚期或转移性 NSCLC 的既往一线治疗
5.使用 FISH 检测(中心实验室或当地)肿瘤组织(TBx)或基于中心实验室的血液下一代测序(LBx)确定的 MET 扩增。在预筛选时,必须在既往一线奥希替尼治疗进展后采集肿瘤和血液样本。o必须提交一线奥希替尼治疗进展后获得的肿瘤组织和血液样本,用于所有患者的 MET 扩增检测 对于通过当地 FISH 检测肿瘤组织的患者,必须在预筛选或筛选期间提交肿瘤组织,以确认 MET 扩增状态。研究治疗开始前不强制要求中心实验室确认。
6.任何其他可能适用于方案的纳入标准。
排除标准
1.脊髓压迫或脑转移,除非在研究干预开始前至少 2 周内无症状、稳定或不需要类固醇治疗。
2. 根据 NCI-CTCAE 第 5 版,先前抗癌治疗产生的任何 2 级或以上未消退毒性,脱发除外。
3. 血液,肝和肾功能低下
4. ILD 或间质性肺炎史,包括需要类固醇治疗的放射性肺炎。
5. 心脏功能受损
6. 标准治疗控制不佳的高血压(未稳定至<150/90 mmHg)。
7. 存在奥希替尼给药的禁忌症。
8. 主要研究者认为妨碍受试者参加本研究的任何其他原因。
研究者信息
1、主要研究者信息
姓名:吴一龙
学位:学士学位
职称:科室主任
单位名称:广东省人民医院
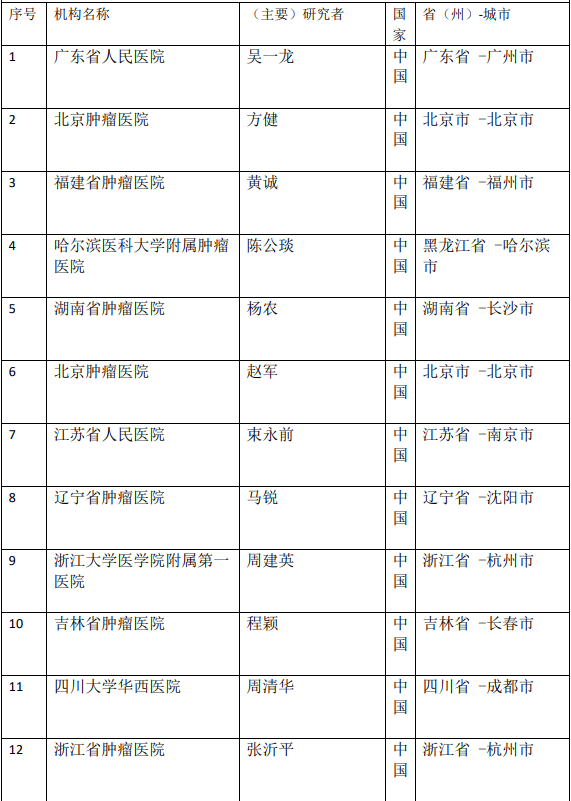
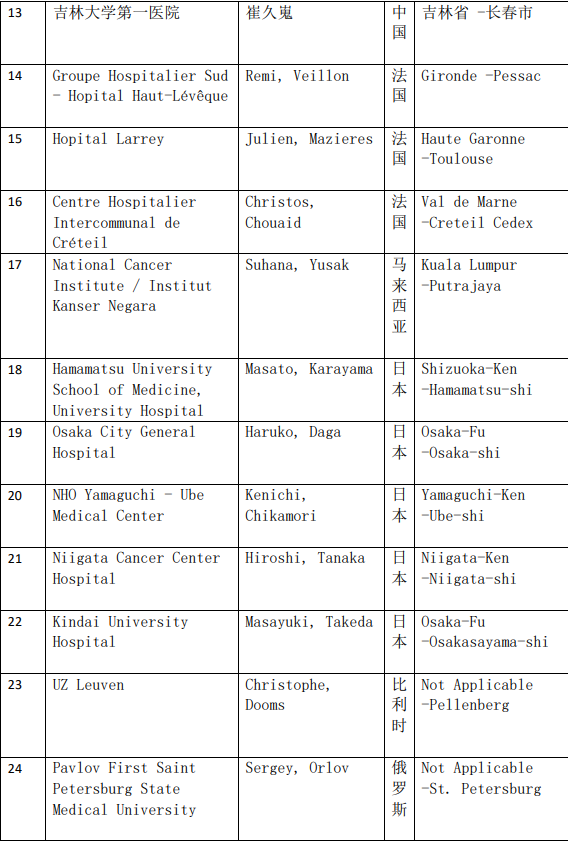
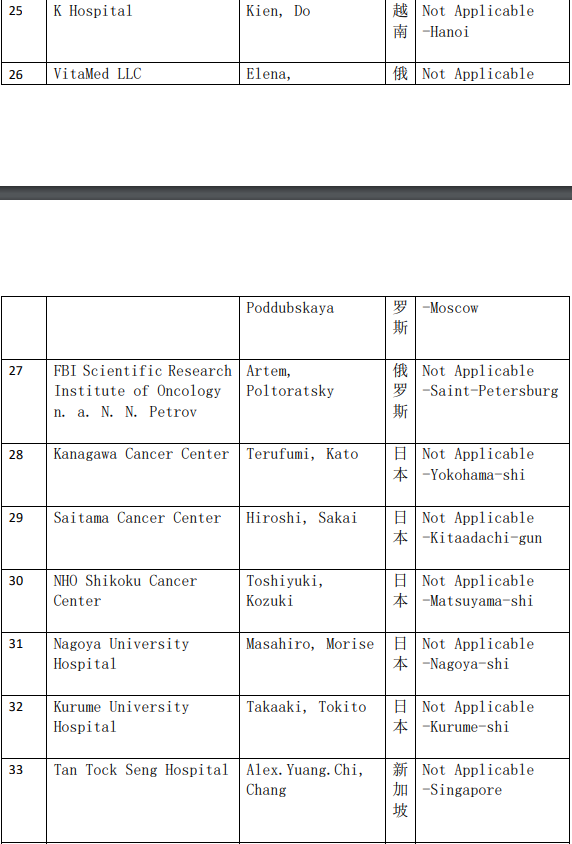
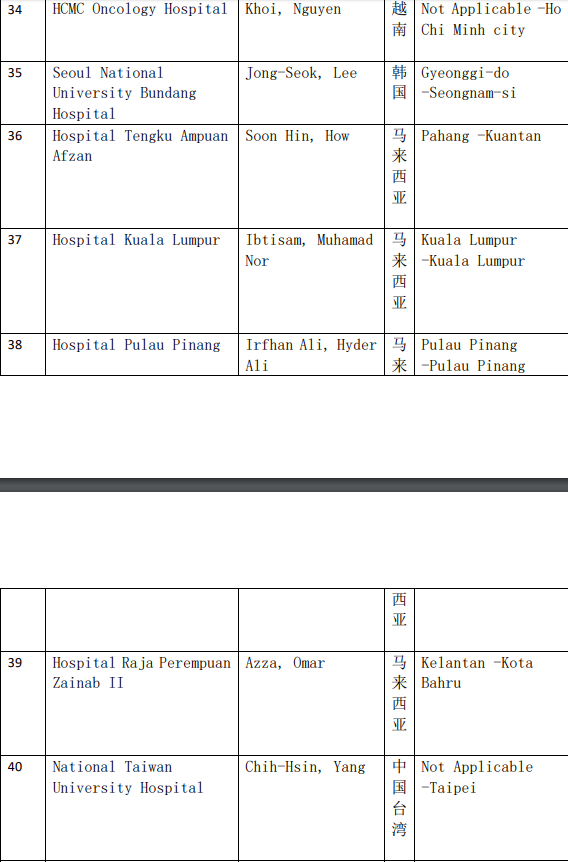
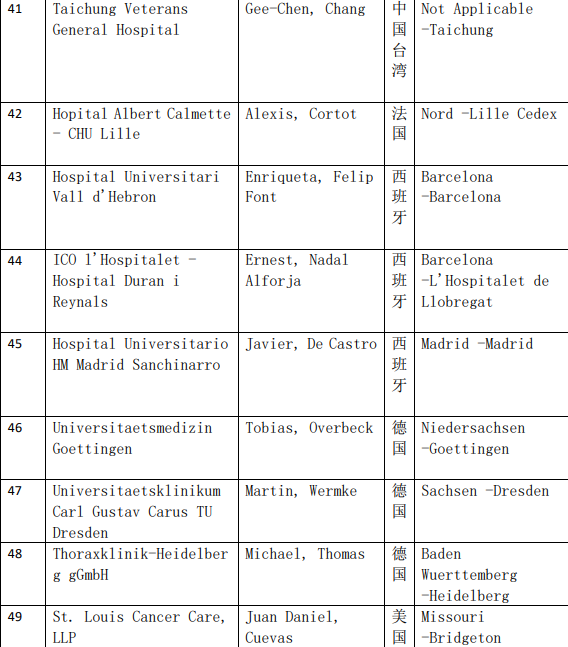
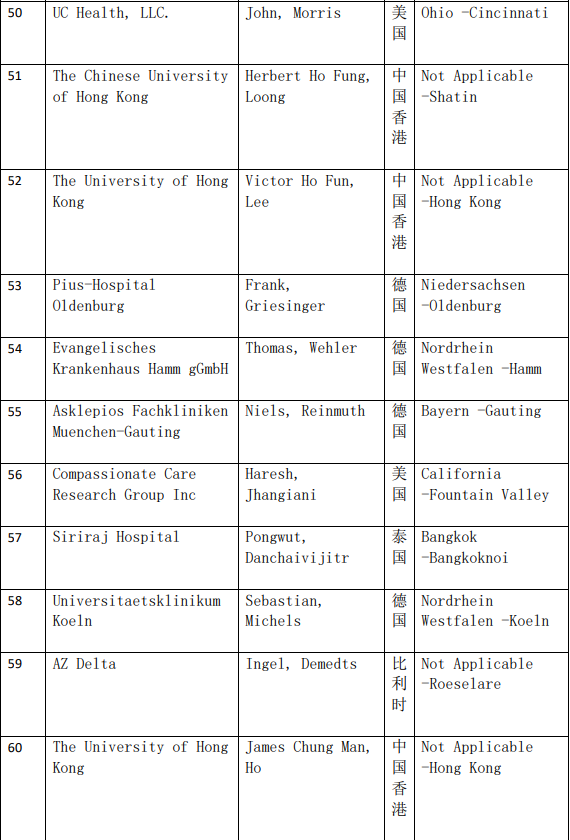
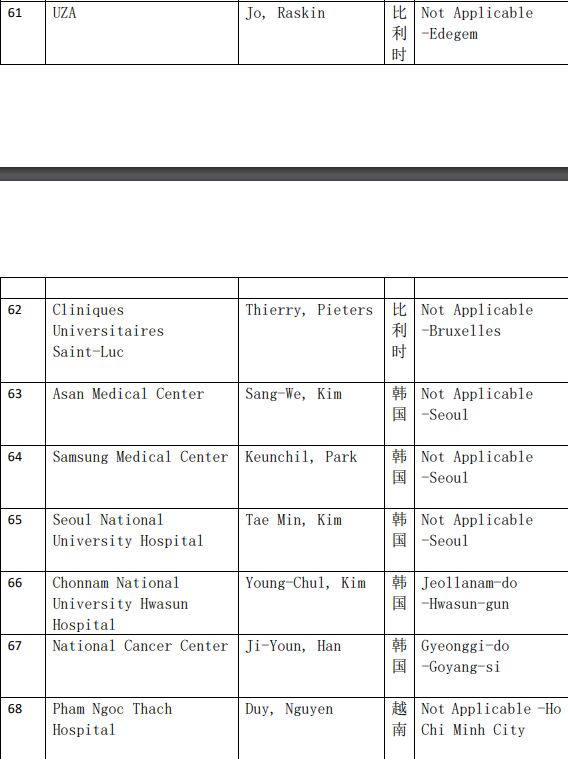
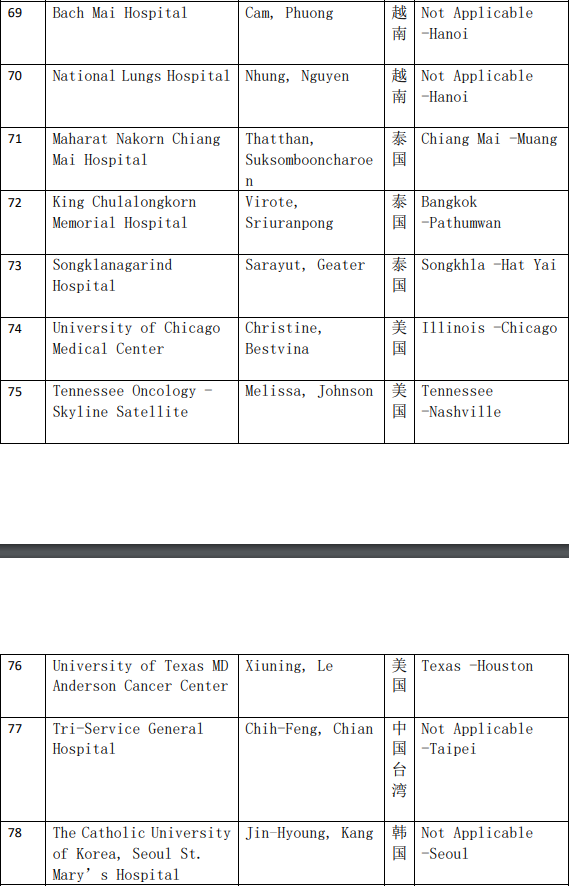
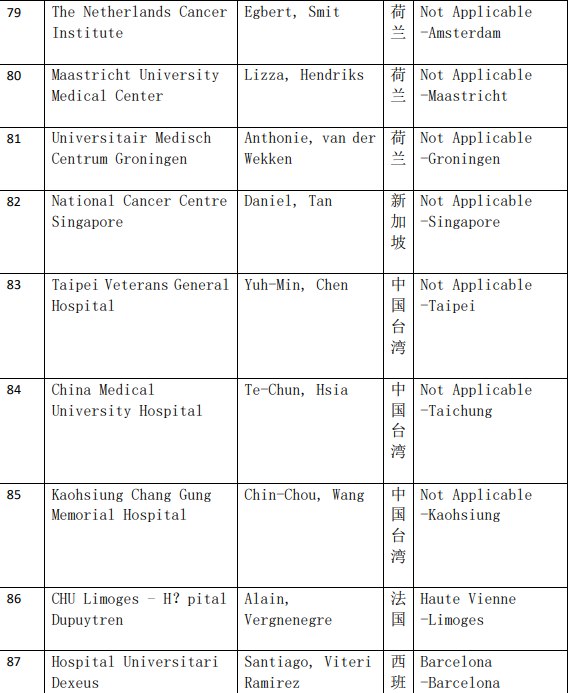
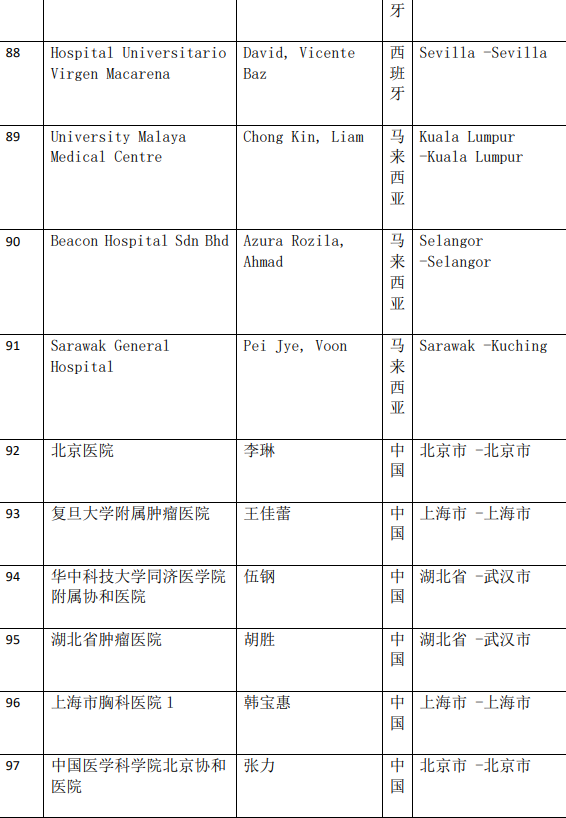
2、各参加机构信息




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城