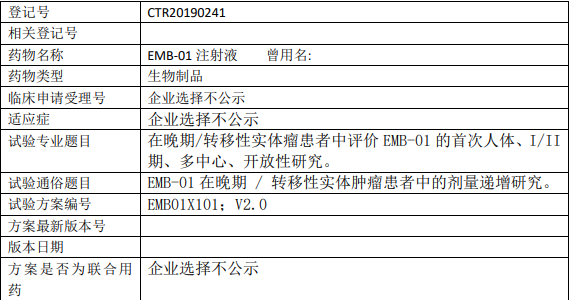
EMB-01临床试验,EMB-01注射液在晚期/转移性实体肿瘤患者中的剂量递增研究
1、试验目的
本实验的主要目的是评价 EMB-01 静脉(IV)给药的安全性和耐受性;确定 EMB-01的最大耐受剂量(MTD)和/或 II 期推荐剂量(RP2D)。
2、试验设计
试验分类:安全性和有效性
试验分期:其它
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
3、受试者信息
年龄:18 岁(最小年龄)至无岁(最大年龄)
性别:男+女
健康受试者:无
入选标准
1.能够理解并愿意签署知情同意书(ICF)。
2.年满 18 岁,男女不限。
3.经组织学/细胞学确认且伴有可测量病灶的晚期/转移性实体瘤(RECIST 1.1 版):
I 期: 标准治疗难治或尚无标准治疗的晚期/转移性实体瘤(包括但不限于 NSCLC、结直肠癌、胃癌和肝癌)。
II 期: 接受过标准治疗(包括铂类药物治疗)并且接受任何 EGFR TKI 治疗后疾病进展的 EGFR 突变型 NSCLC 患者或对任何 EGFR TKI不耐受的 EGFR 突变型患者。
4.具备适当的器官功能
5.既往抗肿瘤治疗:
a. 必须在 EMB-01 首次给药前至少 4 周或在研究药物的 5 个半衰期内(以较短者为准)停止治疗。
b. 全身放疗的受试者必须在 EMB-01 首次给药前 3 周停止治疗,局部放疗或骨转移放疗受试者必须在 EMB-01 首次给药前 2 周停止治疗。EMB-01 首次给药前 8 周内未使用治疗性放射性药物。
6.I 期研究 ECOG 评分为 0 或 1 分,II 期研究 ECOG 评分≤2 分。
排除标准
1.预期寿命不到 3 个月。
2. 罹患原发性中枢神经系统(CNS)恶性肿瘤或伴有症状性 CNS(脑膜或大脑)转移的受试者
3. 妊娠或哺乳期妇女。
4. 在筛选前 28 天内接受过大手术。
5. 原已存在其他严重的内科(例如,无法控制的糖尿病、无法控制的活动性感染、活动性胃溃疡、无法控制的癫痫发作、脑血管意外、胃肠出血、重度凝血障碍体征和症状、心脏疾病)、精神、心理、家族或地方疾病,研究者认为其会干扰计划分期、治疗和随访、影响受试者依从性或使受试者处于治疗相关并发症的高危状态。
研究者信息
1、主要研究者信息
姓名:吴一龙
学位:医学学士
职称:教授;主任医师
单位名称:广东省人民医院
2、各参加机构信息
| 序号 | 机构名称 | (主要)研究着 | 国家 | 省(州)-城市 |
| 1 | 广东省人民医院 | 吴一龙 | 中国 | 广东-广州 |
| 2 | Gabrail Cancer Center Research | Nashat Y. Gabrail | 美国 | Ohio-Canton |
| 3 | Barbara Ann Karmanos Cancer Institute | Ulka Vaishampayan MD | 美国 | Michigan-Detroit |




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城