中国国内实体瘤CAR-T临床试验,广谱抗癌药拉罗替尼临床试验招募正式开始
提到大名鼎鼎的CAR-T和广谱抗癌药拉罗替尼,几乎无人不知,这两款疗法在上市时另整个医疗界和癌友圈都为之沸腾,这些疗法的研发成功,让人们看到了”无进展生存“癌症的希望!
然而,对于这两款美国的新型疗法,中国的病友仅有个别经济条件雄厚的患者选择前往美国接受治疗,大部分病友只能望药兴叹。首先是因为美国CAR-T疗法和拉罗替尼非常昂贵,CAR-T一个疗程的费用为40-50万美元,拉罗替尼每个月的治疗费为32800美元,没有几个家庭能承受的起。另一个原因是美国CAR-T疗法目前只在血液肿瘤中获批,对于实体瘤仍在较早期的研究中。国内的患者迫切期待这些抗癌疗法能早日在中国开展临床试验。
好消息是,由中国自主研发靶向claudin18.2 的CAR-T细胞疗法以及美国上市新药拉罗替尼终于在国内开始招募实体肿瘤患者了!这意味着,国内的患者也终于有机会免费用上这些堪称天价的抗癌新疗法!
直播预告|如何参加抗癌新药的临床试验
在抗肿瘤新药不断更新的今天,很多患者通过参加临床试验获得了免费试用药物的机会,通过疗效更好的新药,获得了更长的生存获益和更多的治疗机会,对明确了获益机会的患者而言,临床实验可能是 的治疗选择。那么肿瘤患者究竟如何参加CAR-T疗法和拉罗替尼的临床试验呢?
2020年7月16日,全球肿瘤医生网特别邀请北京大学肿瘤医院齐长松博士为大家详细讲解这两项临床试验的入排标准以及目前的临床试验进展,希望帮助更多的患者接受这些前沿疗法的治疗,获得更长的生存期。
◀直播内容▶
什么是临床试验
CLAUDIN18.2 CAR-T疗法临床招募介绍
拉罗替尼临床招募介绍
北京大学肿瘤医院相关临床试验研究进展
◀直播时间▶
2020年7月15日(周三) 20:00-
◀报名方式▶
1.
2.扫描以下二维码或点击在线咨询报名!

温馨提示:想参加直播的病友可将病理报告,免疫组化报告,基因检测报告电子版或拍照发送doctor.huang@globecancer.com,邮件中留下联系方式,我们的顾问将为您全面分析检测报告,匹配能够入组的临床试验,以及有无新药可以使用。
主讲嘉宾介绍

齐长松
北京大学肿瘤医院消化内科
主治医师
医学博士
主要从事实体瘤细胞免疫治疗、胃肠肿瘤的综合诊疗、腹膜转移癌的转化治疗、GIST的个体化治疗及NGS指导下消化系统肿瘤的精准治疗。
任:中国临床肿瘤学会(CSCO)胃肠间质瘤专委会委员、秘书;中国抗癌协会肿瘤营养与支持治疗专业委员会癌性肠梗阻学组委员;中国临床肿瘤学会(CSCO)青年委员会统计小组成员;《肿瘤综合治疗电子杂志》编委等。
临床试验介绍
01、靶向claudin18.2的CAR-T细胞疗法招募实体瘤
近两年,我们国家的实体肿瘤取得了备受世界瞩目的成绩,研发出了国际上首个靶向Claudin18.2的实体瘤CAR-T疗法。
Claudin18.2(CLDN18.2)是一种胃特异性膜蛋白,被认为是胃癌和其他癌症类型的潜在治疗靶点。基于此,中国研究人员开发了国际上首个针对 Claudin18.2 的 CAR-T 细胞。
2019 ASCO年会上,CAR-Claudin18.2 T 细胞治疗胃癌/胰腺癌的临床数据更新显示,靶向claudin18.2 CAR T细胞治疗12例转移性腺癌(胃癌7例,胰腺癌5例),未发生严重不良事件、治疗相关死亡或严重神经毒性。
11例评估对象中:
1例(胃腺癌)完全缓解;
3例(胃腺癌2例胰腺腺癌1例)部分缓解;
5例病情稳定;
2例病情进展;
总客观缓解率为33.3%。
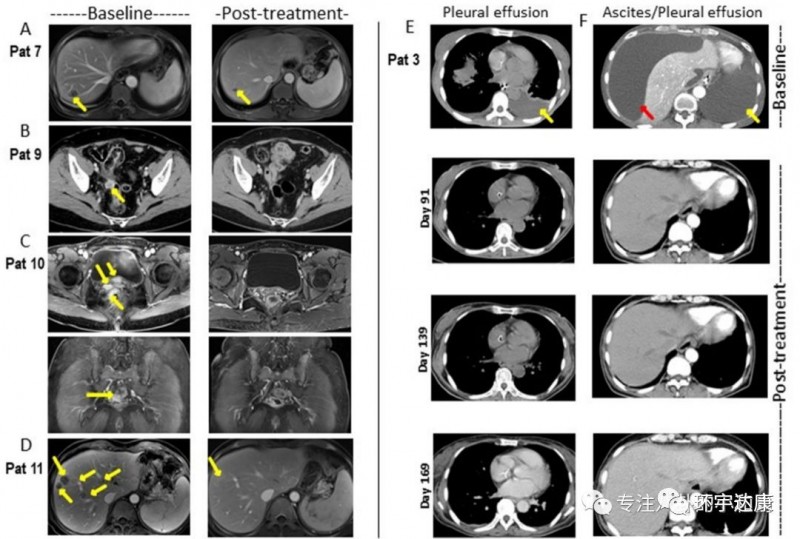
并且,CAR-Claudin18.2 T 细胞治疗胃癌的临床前研究成果显示,靶向Claudin18.2的CAR-T细胞在小鼠模型中可以完全清除胃肿瘤,且没有发生脱靶毒性。
好消息是,这项试验已经率先由国内胃肠道肿瘤享负盛名的北京大学肿瘤医院胃肠肿瘤科开展,评估自体人源化抗claudin18.2嵌合抗原受体T细胞在晚期实体瘤中的安全性及功效。
招募信息
| 疾病 | 治疗 | 阶段 |
| 晚期实体肿瘤(晚期胃癌,食管胃交界癌) | 药物:CAR-CLDN18.2 T细胞 | 阶段1 |
入组标准(部分)
1.年龄18至75岁,男性或女性;
2.患有病理证实的实体瘤(即晚期胃癌,食管胃交界癌和胰腺癌)并且经标准治疗失败的受试者;
3.Claudin 18.2 IHC染色阳性;
4.预计寿命> 12周;
02、堪称天价的“无进展生存系”抗癌药拉罗替尼正式在国内招募
2018年11月26日,整个医疗界和癌友圈都为一款FDA新批准上市的抗癌药物沸腾,这就是全球首个不区分肿瘤来源用于初始治疗的靶向药--Vitrakvi ®(拉罗替尼,larotrectinib,下文统称拉罗替尼),用于成人和小儿具有神经营养受体酪氨酸激酶(NTRK)基因融合的实体瘤治疗。
这在肿瘤治疗史上是一个振奋人心的里程碑。
这款药物之所以让人印象深刻,最大的三个看点在于:
第一,不限癌种。这意味着,只要存在NTRK融合,包括乳腺癌、结直肠癌、肺癌、甲状腺癌等17种癌症类型,同时对成人和儿童都是可以使用的。并且对于婴儿纤维肉瘤和甲状腺癌,胃肠间质瘤的无进展生存率可以高达100%!
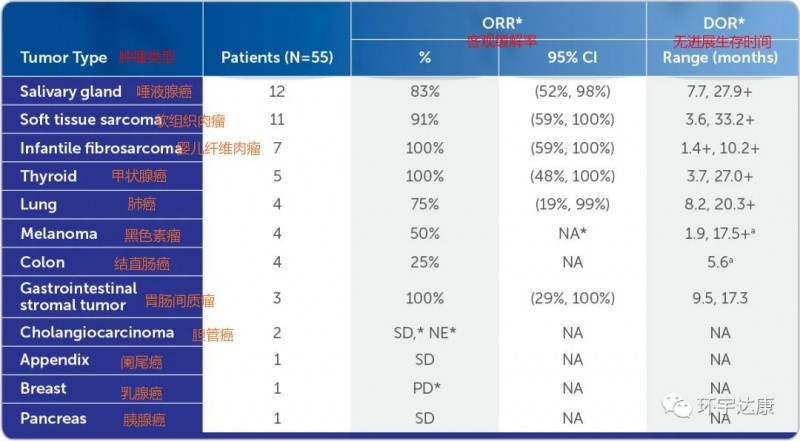
各类癌症的客观缓解率和中位缓解时间
第二,总缓解率高达75%。在TRK融合癌患者的三项大型临床试验汇总数据显示,拉罗替尼的总缓解率高达ORR为75%,其中22%的患者完全缓解。
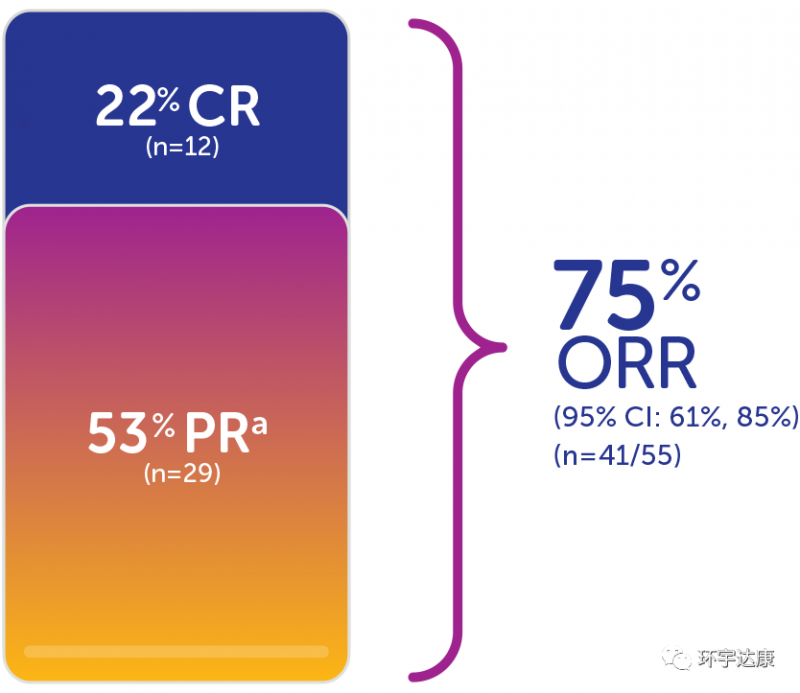
第三,快速持久的响应。这款药物的神奇之处在于,起效非常快,并且一旦有效,带来的缓解往往是出乎意料的。数据显示,平均的起效时间仅为1.84个月,73%的患者响应的持续时间超过6个月。(一个案例报道显示,2岁的梭形细胞肉瘤女孩再接受拉罗替尼治疗后24小时内就出现了快速响应,症状迅速改善。
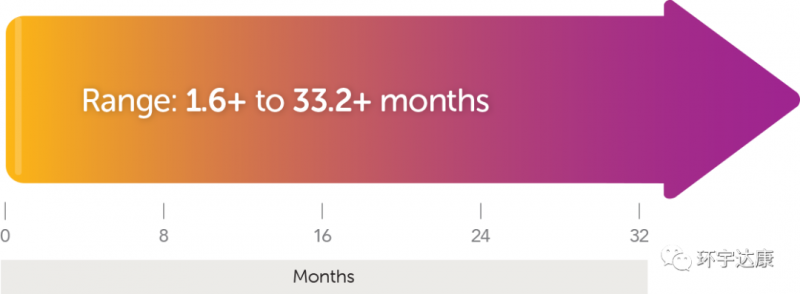
+表示正在进行的响应。截至数据发表时,还有患者处于持续缓解中
1.LOXO-101药品信息
药物名称:Vitrakvi(Larotrectinib,拉罗替尼,又名LOXO-101)
美国上市时间:2018年11月26日
药物功效:有效对抗由单一罕见基因(NTRK)突变驱动的各种癌症
针对人群:患有实体肿瘤的成人和儿童患者
制造企业:Bayer(拜耳)和Loxo Oncology共同研发
药品价格:32800美元/月
使用剂量:
成年人:Larotrectinib对成年人的剂量是每天口服100mg,每天两次,直至疾病进展或出现不可接受毒性!;
儿童按年龄和体重使用剂量:体表面积小于1.0米的儿科患者,Vitrakvi的推荐剂量是100mg/m2 ,每日口服两次,与或不与食物同服。
不良反应剂量调整:出现3级或4级不良反应,减少用量直至改善或不良反应1级。如果不良反应在4周内改善,则在下一次计量时恢复。如果4周内不良反应无法消退,则永久停用Vitrakvi。
2.哪些癌症可以使用
这个靶向药不仅疗效显著,还是广谱抗癌药物,对很多不同肿瘤都有效!这也这个药品这么吸引眼球的原因。
在实验中,这些患者肿瘤类型包括10种不同的软组织肉瘤,唾液腺癌,婴儿纤维肉瘤,甲状腺,肺,黑素瘤,结肠,胃肠道间质瘤(GIST),乳腺癌,骨肉瘤,胆管癌,原发性未知癌,先天性中胚层肾癌,阑尾和胰腺癌。
PD1免疫药物被批准用于MSI-H分子类型的各种肿瘤,成为第一个“广谱免疫药物”。LOXO-101很有可能后来者居上,应该会是第一个上市的“广谱靶向药物”。
因此,只要你经过基因检测,存在NTRK1、NTRK2或者NTRK3基因融合,理论上都是适合的!
3.如何检测NTRK基因
Rossy提醒大家,在一些罕见的癌症中,NTRK融合经常发生。这些包括婴儿纤维肉瘤,分泌型乳房癌等。这些罕见癌症通常会发现NTRK融合,这些患者可能会受益于larotrectinib等药物。
做过癌症基因组检测的晚期癌症患者可能会发现他们的肿瘤存在TRK融合,因为这种基因组事件已在许多肿瘤类型中被描述,包括:
急性髓性白血病
星形细胞瘤
脑低级别胶质瘤
乳腺癌
结直肠癌
先天性中胚层肾瘤
胃肠道间质瘤
多形性胶质母细胞瘤
头颈部鳞状细胞癌
肝内胆管细胞癌
肺癌
唾液腺来源的乳腺类似物分泌癌
黑色素瘤
肉瘤
分泌性乳腺癌
甲状腺癌
一般检查融合基因需要使用二代基因检测技术。而且一定注意是NTRK基因与其他基因融合发生的突变,而不是一个随便的点突变。
全球的基因检测公司凯瑞思和Foundation Medicine最近也研发了Foundation One CDx用于NTRK融合检测,想了解的患者可以登录全球肿瘤医生网医学部咨询。
4.国内患者如何接受治疗
除了美国,2019年9月,拜耳公司宣布,欧盟委员会已在欧盟(EU)授予肿瘤精准治疗药物拉罗替尼的上市许可,该药物适用于治疗局部晚期、远端转移、无法手术切除或手术疗效欠佳的、且无满意替代治疗方案的神经营养性受体酪氨酸激酶(NTRK)基因融合的成人和儿童实体瘤患者。包括德国、法国、意大利等国家均可使用。
近日,我们得到拜耳公司的信息,目前“无进展生存系”抗癌药拉罗替尼针对成人实体瘤和儿童实体瘤的两项试验终于正式在国内开始招募患者了!这意味着,国内的患者也终于有机会免费用上这款美国的抗癌“特药”!
这项研究是为了验证拉罗替尼对不同类型的肿瘤疗效。这些肿瘤必须存在一种特定的基因变化(NTRK1, NTRK2或NTRK3)。Larotrectinib是一种试验性的药物,可以阻止这些NTRK基因在癌细胞中的作用,因此可以用来治疗肿瘤。
试验分期:II期
主要终点指标:由独立放射学审查委员会测定 总缓解率
入组人数:总体140人 中国13人
预计入组结束时间:中国2021年8月31日
| 序号 | 机构名称 | 项目负责人PI | 城市 |
| 1 | 中山大学附属肿瘤防治中心 | 徐瑞华 | 广州 |
| 2 | 复旦大学附属中山医院 | 刘天舒 | 上海 |
| 3 | 四川大学华西医院 | 刘咏梅 | 成都 |
| 4 | 北京大学肿瘤医院 | 沈琳 | 北京 |


































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城