FDA批准靶向HER2的抗体偶联(ADC)药物德曲妥珠单抗(Enhertu、DS8201、T-DXd、Trastuzumab deruxtecan)治疗既往接受过治疗的转移性HER2阳性实体瘤
据阿斯利康(AstraZeneca)官网消息,2024年4月5日,一款重磅抗癌药-Enhertu®(DS-8201)获美国食品和药品监督局(FDA)批准,用于治疗既往接受过治疗的转移性HER2阳性实体瘤患者,作为首款获批的针对HER2阳性的泛实体瘤ADC药物,消息一出立即引爆抗癌圈。
Enhertu®真正发挥了其在转移性HER2靶向肿瘤中的潜力。简单来说,几乎所有HER2阳性的实体瘤患者均可使用,而无需考虑癌症类型、癌细胞在体内的位置等限制性因素,这无疑会让更多的癌症患者获益,同时也标志着HER2-ADC的时代正式来临!

▲截图源自“AstraZeneca官网”
全癌种都可用的"神奇"抗癌药:DS-8201
DS-8201(又称Enhertu®、T-DXd、德曲妥珠单抗、Trastuzumab deruxtecan)是一种靶向人表皮生长因子2(HER2)的新型抗体药物偶联物(ADC),由新型有效的喜树碱类似物拓扑异构酶I抑制剂(DXd)、新开发的酶切割连接子、人源化的抗HER2抗体三部分组成,可同时杀伤目标肿瘤细胞及邻近肿瘤细胞。
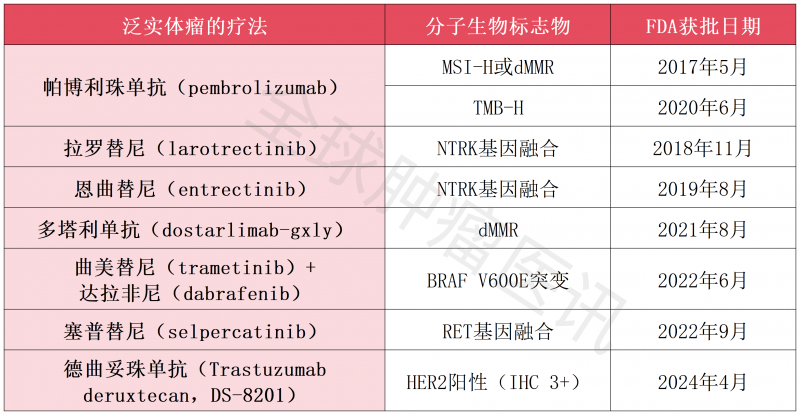
DS-8201是继引领免疫治疗变革的PD-1抑制剂(针对MSI-H患者)及部分靶向药(针对RET、NTRK等基因阳性)后,首款具有不限癌种适应症的ADC药物,这也意味着泛实体瘤治疗的生物标志物队列中,自此新增了重要一员——HER2(详见下表)。困扰患者多时的“超适应证用药”问题,也将迎刃而解!
表1 获FDA批准的泛实体瘤疗法及生物标志物
HER2是一种酪氨酸激酶受体促生长蛋白,在全身各种组织细胞表面表达,且参与正常细胞的生长。HER2在某些癌症中(如胃癌、乳腺癌、结直肠癌、肺癌等)表达增强或细胞具有激活突变,其过度表达通常与侵袭性疾病和不良预后相关。鉴于其在多种实体瘤中的关键作用,建议肿瘤患者进行基因检测,以明确适合的靶向药物,为晚期肿瘤患者提供潜在的治疗机会。
做了基因检测的病友可以拿出检测报告看看,若发现HER2突变,可咨询医学部,进行初步评估是否有机会获得国内外抗癌新药的帮助。看不懂的病友也可致电医学部,详细解读报告。
DS-8201获批的五类适应证
近年来,DS-8201凭借不俗的广谱抗癌疗效数据,在不断革新的抗HER2治疗领域脱颖而出,成为近年来备受关注的对象,目前DS-8201共有如下五类适应证获批:
01、不可切除或转移性HER2阳性(IHC3+或ISH阳性)乳腺癌,既往接受过基于抗HER2的治疗方案。
02、转移性或不可切除的HER2-low(IHC1+或IHC2+/ISH-)乳腺癌,且既往接受过化疗,或在化疗期间/6个月内,出现疾病复发并完成辅助化疗。
03、局部晚期或转移性HER2阳性(IHC3+或IHC2+/ISH阳性)胃或胃食管交界腺癌,既往接受过曲妥珠单抗治疗方案。
04、不可切除或转移性HER2(ERBB2)突变的非小细胞肺癌,既往接受过全身治疗。
05、无法切除或转移性HER2阳性(IHC3+)实体瘤(最新获批),既往接受过全身治疗,且无其他满意的替代治疗方案。
DS-8201打破HER2阳性癌种限制,客观缓解率可达52.9%
DS-8201本次获批主要是基于三项临床试验(DESTINY-PanTumor02、DESTINY-Lung01、DESTINY-CRC02)的疗效评估结果,192例转移或不可切除的HER2阳性(IHC3+)实体瘤的成年患者,既往参加了这三项临床试验中的一项。
1、DESTINY-PanTumor02试验(NCT04482309)
入组患者中位年龄为62岁(范围为23-85岁),患有经组织学证实的局部晚期/不可切除或转移性胆道癌、膀胱癌、宫颈癌、卵巢癌、胰腺癌、其他实体癌[包括唾液腺癌(n=19)、原发部位不明的恶性肿瘤(n=5)、外佩吉特病(n=3)、皮肤黑色素瘤(n=2)、口咽肿瘤(n=2)、腺样囊性癌、头颈癌、唇癌和/或口腔癌、食管腺癌、肠腺癌、阑尾腺癌、食管鳞状细胞癌、睾丸癌等(所有n=1)]。截至数据截止(2023年6月8日),所有队列的中位随访时间为12.75个月。
结果显示,治疗后客观缓解率(ORR)达51.4%(95%CI:41.7,61.0)(详见下图),中位缓解持续时间(DOR)为19.4个月(范围1.3,27.9+)。
图1 根据中心测试的HER2状态,各肿瘤队列的ORR
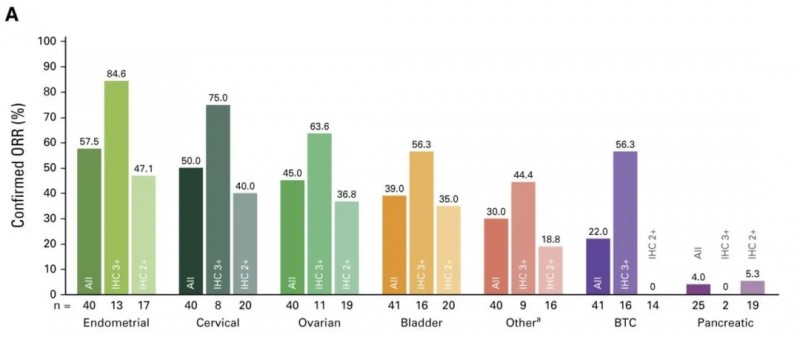
▲图源“J Clin Oncol”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、DESTINY-Lung01临床试验(NCT03505710)
结果显示,治疗后客观缓解率(ORR)为56%,中位缓解持续时间(DOR)为6.9个月(范围4.0,11.7+)。
3、DESTINY-CRC02临床试验(NCT04744831)
结果显示,治疗后客观缓解率(ORR)为46.9%(95%CI:34.3,59.8),中位缓解持续时间(DOR)为5.5个月(范围1.3+,9.7+)。
DS-8201中国获批治疗HER2-low乳腺癌,疾病进展风险降低近50%
2022年世界癌症顶级会议——美国ASCO(临床肿瘤学会)年会上,公布了DS-8201(德曲妥珠单抗)超乎想象的DESTINY-Breast04 Ⅲ期临床试验(NCT03734029)结果,并发表在《新英格兰医学杂志》上。
本次入组的患者为HER2低表达的转移性乳腺癌患者,且既往接受过1~2种化疗。这些患者按2∶1的比例随机分配为两组,即德曲妥珠单抗组(n=371,接受德曲妥珠单抗治疗)、化疗组(n=172,接受医生选择的普通化疗方案)。结果显示(截至2022年1月11日):
1、中位无进展生存期(PFS):德曲妥珠单抗组PFS为10.1个月(95%CI,9.5-11.5)、化疗组PFS仅为5.4个月(95%CI,4.4-7.1)。与普通化疗组相比,德曲妥珠单抗将疾病进展和死亡风险降低了约50%(详见下图)!
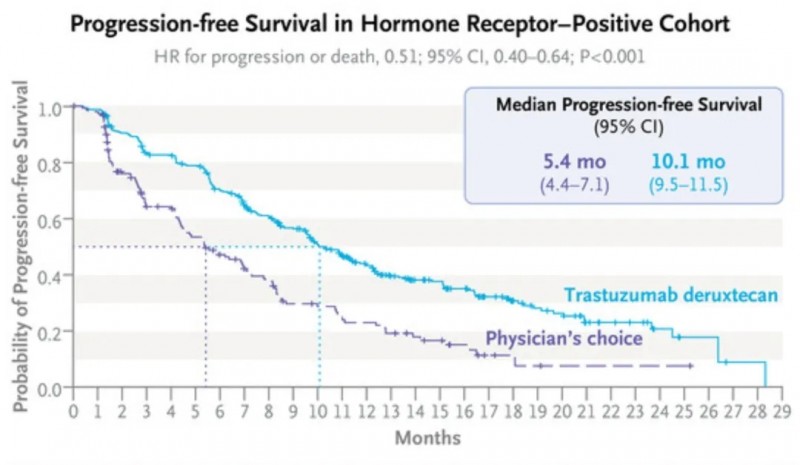
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、中位总生存期(OS):德曲妥珠单抗组OS为23.9个月(95%CI,20.8-24.8),而化疗组仅为17.5个月(95%CI,15.2-22.4)(详见下图)。
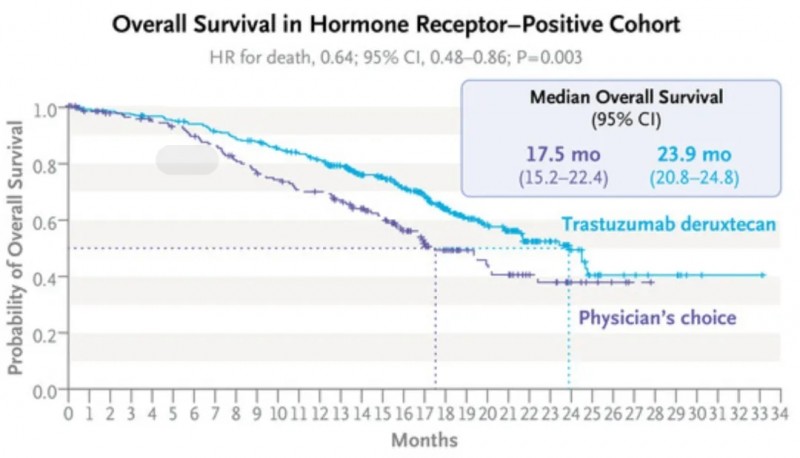
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
3、客观缓解率(ORR):德曲妥珠单抗组的ORR高达52.3%(95%CI,47.1%-57.4%),而化疗组仅为16.3%(95%CI,11.3%-22.5%)。
总之,上述数据表明,与普通化疗组相比,德曲妥珠单抗治疗组患者的无进展生存期和总生存期显著延长。也正是基于如此优异的临床数据,2023年2月,中国国家药品监督管理局(NMPA)批准德曲妥珠单抗(即DS-8201)作为单一疗法,用于治疗既往接受过全身系统治疗的不可切除或转移性HER2-low(IHC1+或IHC2+/ISH-)乳腺癌成年患者。
DS-8201治疗非小细胞肺癌,疾病控制率高达95%

▲截图源自“ASCO Publications”
DS-8201(德曲妥珠单抗)是首个也是唯一一款获批用于治疗HER2转移性非鳞状非小细胞肺癌(mNSCLC)的HER2靶向疗法,其在多种癌症适应症中显示出强大的抗肿瘤活性。DS-8201的临床益处在II期DESTINY-Lung01试验中得到证实。结果显示:
接受DS-8201(6.4mg/kg)治疗的患者,其客观缓解率(ORR)达到56%,中位缓解持续时间(DoR)为10.6个月,中位无进展生存期(PFS)为8.2个月,中位总生存期(OS)为18.6个月。
接受DS-8201(5.4mg/kg)治疗的患者,其客观缓解率(ORR)为49.0%,疾病控制率(DCR)高达95%(详见下图)。
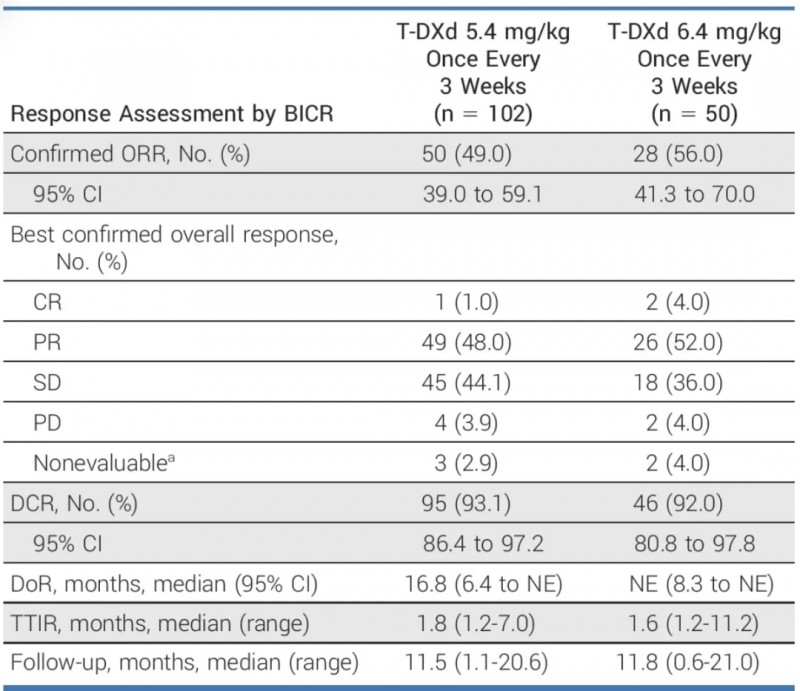
▲图源““J Clin Oncol”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
HER2在胃癌、肺癌、结直肠癌、乳腺癌、胆道癌、膀胱癌、宫颈癌、卵巢癌、胰腺癌等多种实体瘤中表达。本次DS-8201的获批及既往惊艳的临床疗效,属实令人惊喜,在实体瘤靶向药研发领域留下了浓墨重彩的一笔,未来将有大批HER2阳性实体瘤患者受益于DS-8201这款“神奇”的抗癌药!
全球肿瘤医生网小编也期望我国能加快各类抗癌药物研发及审批上市的速度,同时让更多效果好的抗癌药尽快纳入医保,让更多的癌症患者获益!符合HER2阳性突变的癌友,可联系医学部,申请国内外抗癌专家会诊,评估适合的用药方案;或进行初步评估,看能否参加方舟计划获得免费用药的机会。
参考资料
[1]Modi S,et al.Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer[J].New England Journal of Medicine, 2022, 387(1): 9-20.
https://www.nejm.org/doi/full/10.1056/NEJMoa2203690
[2]Goto K,et al.Trastuzumab deruxtecan in patients with HER2-mutant linkstatic non–small-cell lung cancer: Primary results from the randomized, phase II DESTINY-Lung02 trial[J].Journal of Clinical Oncology, 2023, 41(31):4852.
https://ascopubs.org/doi/full/10.1200/JCO.23.01361
[3]Meric-Bernstam F,et al.Efficacy and Safety of Trastuzumab Deruxtecan in Patients With HER2-Expressing Solid Tumors: Primary Results From the DESTINY-PanTumor02 Phase II Trial. J Clin Oncol. 2024 Jan 1;42(1):47-58.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10730032/
[4]https://www.astrazeneca-us.com/media/press-releases/2024/enhertu-approved-in-the-us-as-first-tumor-agnostic-her2-directed-therapy-for-previously-treated-patients-with-linkstatic-her2-positive-solid-tumors.html
[5]https://www.onclive.com/view/trastuzumab-deruxtecan-approved-in-china-for-her2-low-linkstatic-breast-cancer
[6]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-fam-trastuzumab-deruxtecan-nxki-unresectable-or-linkstatic-her2


































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城