速存!2025第四季度中美两国十大抗癌新药获批在即,横扫肺癌、胃癌、乳腺癌等六大癌种
根据OncLive报道,随着2025年第四季度启动,肿瘤学界正密切关注FDA的多项关键监管决策。未来数月内,一系列治疗领域的药物若顺利获批,将催生新治疗方案并重塑现有治疗标准,其中10项FDA决定尤为值得关注。
为帮助广大癌症患者坚定治疗信心,小编第一时间梳理汇总了“2025年第四季度有望获批上市的抗癌新药/新技术榜单”。结合当前全球药品审批动态与临床试验进展,本季度有望获批的抗癌新药及新疗法,主要集中在靶向治疗、免疫治疗、细胞疗法及抗体偶联药物(ADC)等核心方向(注:下列信息仅供参考,具体用药方案需遵循医嘱,也可联系医学部,进行初步评估)。
▲截图源自“OncLive”
美国FDA第四季度有望获批上市的六款抗癌新药/新技术
Sevabertinib(BAY 2927088)
药品简介
①药品名称:Sevabertinib(BAY 2927088)。
②研发公司:拜耳。
③适应证:HER2突变型非小细胞肺癌(NSCLC)。
④预计获批时间:2025年11月。
药物详情
Sevabertinib(BAY 2927088)是一款具有双重作用机制的创新药物:作为选择性二氢乳清酸脱氢酶(DHODH)抑制剂,它可通过抑制这一在细胞分裂与DNA合成中起关键作用的酶,阻断癌细胞分裂增殖,目前已开展针对晚期非小细胞肺癌(NSCLC)、骨髓恶性肿瘤的相关研究;同时,它还是强效口服可逆性HER2酪氨酸激酶抑制剂,在携带HER2激活突变的晚期非小细胞肺癌患者中展现出可控的安全性与明确的抗肿瘤活性。
2025年5月28日,Sevabertinib(BAY 2927088)获FDA新药申请优先审查资格,治疗携带HER2突变且既往接受过全身治疗的晚期非小细胞肺癌(NSCLC)成年患者。
临床研究数据
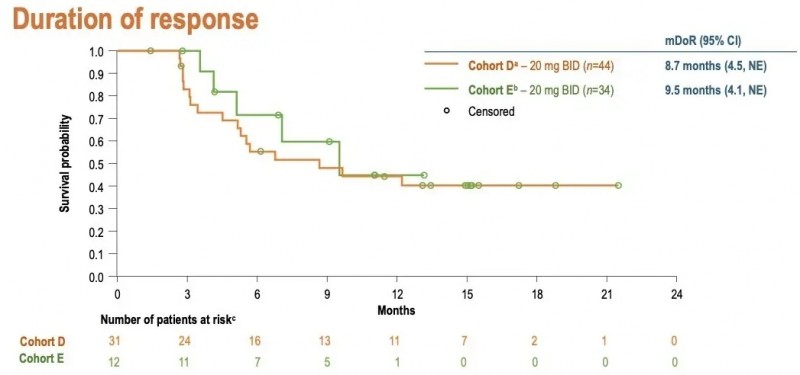
根据1/2期SOHO-01试验(NCT05099172)数据,该药物在不同患者队列中的疗效表现如下:在未接受过HER2靶向治疗的队列D(n=44)中,客观缓解率(ORR)达70.5%(95%CI:54.8,83.2);在既往接受过HER2靶向抗体-药物偶联物治疗的队列E(n=34)中,ORR为35.3%(95%CI:19.7,53.5)。
疾病控制率(DCR,缓解或病情稳定≥12周)分别为81.8%(D组)、52.9%(E组);中位缓解持续时间D组为8.7个月[95%CI:4.5,无法估计(NE)],E组为9.5个月(95%CI:4.1,NE)(详见下图)。
▲图源“ESMO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
瑞维美尼(Revumenib)
药品简介
①药物名称:瑞维美尼(Revumenib,Revuforj®)。
②研发公司:Syndax Pharmaceuticals。
③作用靶点:menin蛋白。
④适应证:复发或难治性(R/R)NPM1突变型急性白血病。
⑤预计审批时间:2025年10月25日。
药物详情
瑞维美尼(Revumenib)是一款Menin抑制剂,2025年6月24日,美国FDA已授予其补充新药申请(sNDA)优先审评资格,适应症为复发或难治性NPM1突变型急性髓系白血病(AML)。
此次补充申请的审查,基于该药物此前已获批用于治疗KMT2A重排急性白血病的基础;若顺利通过,这款首创Menin抑制剂的适用范围将扩展至更广泛的AML患者群体。
临床研究数据
根据1/2期AUGMENT-101临床试验(NCT04065399)数据,在该试验纳入的77例患者中,瑞维美尼的完全缓解(CR)+CR伴部分血液学恢复(CRh)率达26.0%(95%CI:16.6%-37.2%),总体反应率(ORR)为48.1%。
在疗效时间维度上,患者首次达到CR+CRh的中位时间为2.8个月(范围:0.9-8.8个月),CR+CRh的中位持续时间则为4.7个月(95%CI:2.1-8.2个月)。
玛贝妥单抗(Belantamab Mafodotin-blmf方案)
药品简介
①药品名称:玛贝妥单抗(Belantamab Mafodotin,Blenrep®)。
②研发公司:葛兰素史克(中国)。
③治疗靶点:BCMA。
④适应证:二线治疗难治性/复发性多发性骨髓瘤(R/R MM)。
⑤预计审批时间:2025年10月23日。
药物详情
玛贝妥单抗是一款靶向BCMA的抗体偶联药物(ADC),不仅是全球首款获批上市的BCMA靶向疗法,亦是目前唯一获FDA批准用于治疗复发或难治性多发性骨髓瘤的ADC。
2024年11月25日,美国FDA已接受玛贝妥单抗(商品名:Blenrep®)的两项生物制剂许可申请(BLA),分别对应两种联合治疗方案:一是与硼替佐米(Velcade)、地塞米松联合(简称BVd方案),二是与泊马度胺(Pomalyst)、地塞米松联合(简称BPd方案),适应症均为既往接受过至少1种治疗的多发性骨髓瘤患者。
临床研究数据
根据3期DREAMM-7(NCT04246047)和DREAMM-8(NCT04484623)试验数据,两种以玛贝妥单抗(Blenrep®)为基础的联合方案,均较对应标准三联疗法显著改善患者无进展生存期(PFS)。
具体来看,DREAMM-8试验结果显示:玛贝妥单抗联合泊马度胺与地塞米松(BPd方案)组的中位PFS未达到,而标准泊马度胺+硼替佐米+地塞米松(PVd方案)组中位PFS为12.7个月。
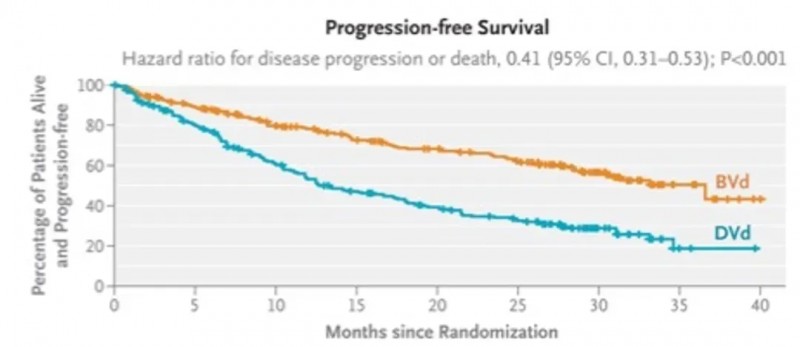
DREAMM-7试验数据则显示:玛贝妥单抗联合硼替佐米与地塞米松(BVd方案)组中位PFS为36.6个月(95%CI:28.4~未达到),显著优于标准硼替佐米+地塞米松+达雷妥尤单抗(DVd方案)组的13.4个月(95%CI:11.1~17.5);长期生存获益方面,BVd组18个月总生存率为84%,同样高于DVd组的73%(详见下图)。
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
度伐利尤单抗(Durvalumab,Imfinzi)围术期治疗
药品简介
①药品名称:度伐利尤单抗(Durvalumab,Imfinzi)。
②研发公司:阿斯利康。
③适应证:可切除的广泛期局部晚期胃癌或胃食管连接部癌。
④预计获批时间:2025年第四季度。
药物详情
2025年7月28日,美国FDA受理了度伐利尤单抗(durvalumab,商品名:Imfinzi)的补充生物制品许可申请(sBLA),并授予其优先审查资格,适应症为可切除的早期局部晚期胃癌及胃食管连接部(GEJ)癌患者的围手术期治疗。若顺利获批,该方案将成为胃癌及GEJ癌领域首个且唯一一个基于围手术期免疫治疗的标准方案,填补该阶段治疗空白。
临床研究数据
根据3期MATTERHORN试验(NCT04592913)数据,围手术期接受度伐利尤单抗联合FLOT方案(含氟尿嘧啶、亚叶酸钙、奥沙利铂、多西他赛)治疗的患者,较单独使用FLOT方案者,疾病进展、复发或死亡风险降低29%。
其中,度伐利尤单抗联合FLOT组的中位无事件生存期(EFS)未达到(NR;95%CI:40.7~NR),单独FLOT组的中位EFS为32.8个月(95%CI:27.9~NR)。
Epcoritamab+R2方案
药品简介
①药品名称:Epcoritamab-bysp(Epkinly)。
②研发公司:Genmab US, Inc。
③适应证:二线治疗复发/难治性(R/R)滤泡性淋巴瘤。
④预计获批时间:2025年11月30日。
药物详情
2025年8月7日,美国FDA接受了Epcoritamab-bysp(商品名:Epkinly)的补充生物制品许可申请(sBLA),并授予优先审查资格。该申请旨在批准这款皮下注射药物,联合利妥昔单抗(Rituxan)与来那度胺(Revlimid,简称R²方案),用于治疗既往接受过至少1种全身治疗的复发/难治性滤泡性淋巴瘤成年患者。
若此次申请顺利获批,epcoritamab联合R²方案将成为全球首个可用于复发/难治性滤泡性淋巴瘤患者二线治疗的双特异性抗体联合方案。
临床研究数据
根据3期EPCOREFL-1试验(NCT05409066)首次中期分析的阳性结果,epcoritamab联合R²(利妥昔单抗+来那度胺)方案,显著改善了意向治疗人群的客观缓解率(ORR)和无进展生存期(PFS)。其中,ORR达95.7%(P<0.0001),PFS风险比(HR)为0.21(P<0.0001)。该联合方案的安全性数据,与方案中各药物已知的安全性特征一致。
利基迈仑赛(liso-cel CAR-T)
药品简介
①药品名称:利基迈仑赛(liso-cel,Breyanzi,lisocabtagene maraleucel)
②研发公司:百时美施贵宝(BMS)。
③适应证:二线治疗复发/难治性边缘区淋巴瘤(R/R MZL)。
④预计获批时间:2025年12月5日。
药物详情
利基迈仑赛(liso-cel,Breyanzi,lisocabtagene maraleucel)是由百时美施贵宝公司研发的一款针对CD19的转基因自体CAR-T细胞疗法。
2025年8月4日,美国FDA受理了利基迈仑赛补充生物制品许可申请(sBLA),并授予其优先审查资格,用于已接受过2线或2线以上全身治疗的复发/难治性边缘区淋巴瘤(MZL)成年患者。若顺利获批,liso-cel有望成为第一个也是唯一一个获批用于治疗这种疾病的CAR-T细胞疗法。
临床研究数据
根据2期TRANSCENDFL试验(NCT04245839)MZL队列的结果,该队列可评估患者的客观缓解率(ORR)达95.5%(95%CI:87.3%-99.1%),其中完全缓解(CR)率为62.1%。
此外,该队列患者的24个月缓解持续时间(DOR)率为88.6%,无进展生存期(PFS)率为85.7%,总生存期(OS)率为90.4%。
中国第四季度有望获批上市的四款抗癌新药/新技术
德达博妥单抗(Dato-DXd)
药品简介
①药品名称:德达博妥单抗(Dato-DXd,代号:DS-1062a,datopotamab deruxtecan)。
②研发公司:默沙东、第一三共制药公司。
③治疗靶点:TROP2。
④适应证:TROP2阳性晚期乳腺癌、肺癌等实体瘤。
⑤预计获批时间:2025年第四季度。
药物详情
德达博妥单抗是第一三共和阿斯利康联合开发的一款靶向Trop-2的DXd抗体偶联药物(ADC),2024年3月16日该药的上市申请获得中国国家药品监督管理局药品审评中心(CDE)受理,用于成人既往接受过系统治疗的HR阳性、HER2阴性的不可切除或转移性乳腺癌的治疗,有望于2025年第四季度(Q4)获批。
临床研究数据
德达博妥单抗(Dato-DXd)的Ⅲ期TROPION-Lung01临床研究结果显示:中位总生存期(OS)分别为12.9个月(Dato-DXd组,范围11.0~13.9) vs 11.8个月(多西他赛组,范围10.1~12.8)。中位无进展生存期(PFS)分别为4.4个月(Dato-DXd组,范围4.2~5.6)vs 3.7个月(多西他赛组,范围2.9~4.2)。
力胜克拉片(国产Bcl-2抑制剂)
药品简介
①药物名称:力胜克拉片(APG-2575片,Lisaftoclax)。
②研发公司:亚盛医药。
③治疗靶点:Bcl-2。
④适应证:复发/难治性(R/R)急性髓系白血病(AML)。
⑤预计获批时间:2025年第四季度。
药物详情
力胜克拉片(APG-2575片,Lisaftoclax)是由苏州亚盛医药自主研发的一款新型选择性Bcl-2抑制剂,2024年11月16日,该药的上市申请获得中国CDE受理并被纳入优先评审,拟用于复发或难治性慢性淋巴细胞白血病(CLL)、小淋巴细胞淋巴瘤(SLL)的治疗。它是首个申报上市的国产BCL-2抑制剂,或将于2025年第四季度(Q4)获批。
临床研究数据
力胜克拉片(Lisaftoclax)治疗慢性淋巴细胞白血病(CLL)的1b/2期临床研究数据显示:客观缓解率(ORR)高达73.3%,CR/CRi率(“完全缓解”或“完全缓解但计数不完全恢复”)达到24.4%(详见下表)。中位无进展生存期(PFS)长达18.53个月(95%CI, 9.13~24.05)。其中,12个月和24个月的PFS率分别为58.0% vs 39.4%。
瑞拉芙普-α注射液(SHR-1701)
药品简介
①药物名称:瑞拉芙普-α注射液(SHR-1701)。
②研发公司:恒瑞医药。
③治疗靶点:PD-L1。
④适应证:胃及胃食管结合部腺癌(G/GEJA)一线治疗。
⑤预计获批时间:2025年第四季度。
药物详情
瑞拉芙普-α注射液(SHR-1701)是一种创新双功能融合蛋白,由靶向PD-L1的IgG4单克隆抗体与TGF-βIIR胞外域融合而成。2024年9月,该药在国内提交上市申请,与氟尿嘧啶类和铂类药物联合,用于局部晚期不可切除、复发或转移性胃及胃食管结合部腺癌的一线治疗。作为全球首个进入上市申报阶段的PD-L1/TGF-β双靶点新药,该药预计于2025年第四季度获批。
临床研究数据
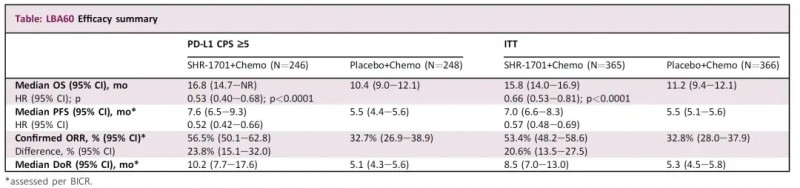
在2024年欧洲肿瘤内科学会(ESMO)大会上,公布了瑞拉芙普-α(SHR-1701)III期临床研究(NCT04950322)的振奋数据。
结果显示:在意向性治疗(ITT)人群中,SHR-1701联合化疗组的中位总生存期(OS)显著优于安慰剂联合化疗组(15.8个月 vs 11.2个月)。此外,SHR-1701联合化疗组的无进展生存期(PFS)、客观缓解率(ORR)和缓解持续时间(DoR)也均优于安慰剂联合化疗组。
▲数据源自“Annals of Oncology”
SA102双靶点CAR-T
药品简介
①药品名称:SA102双靶点CAR-T。
②研发公司:武汉思安医疗。
③适应证:复发/难治性多发性骨髓瘤。
④预计获批时间:2025年第四季度
药物详情
SA102 CAR-T是武汉思安医疗技术有限公司自主研发的双靶点嵌合抗原受体T细胞疗法,也是全球首个获得安全性与有效性临床数据的CS1/BCMA双靶CAR-T产品。
2025年9月4日,这款创新疗法的新药临床试验申请(IND)已正式获国家药品监督管理局药品审评中心(CDE)批准,适应症为复发/难治性多发性骨髓瘤!
临床研究数据
SA1021/2a期临床试验(NCT04662099)数据显示:81%(13/16)患者达到总体缓解并实现微小残留病(MRD)阴性,其中严格完全缓解(sCR)率38%(6/16)。1年总生存率(OS)为62.22%(95%CI:23.90~85.45)(详见下图B),中位无进展生存期(PFS)9.0个月(95%CI:2.1~NR)(详见下图C)。
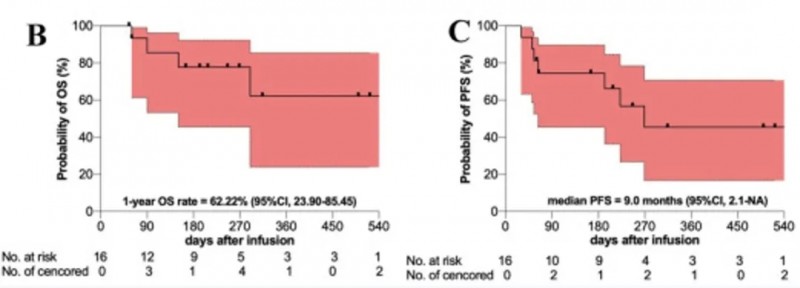
▲图源“Leukemia”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
上文所提及的新药/新技术,不过是众多研发热潮中的冰山一角,实际上还有众多在研的抗癌新药/新技术正在如火如荼地进行中,为广大癌症患者带来了新的希望和更有效的治疗选择。我们也期待这些新药能够顺利通过评审,尽快应用于临床实践,让更多的癌症患者有药可医!
好消息是,当前有多款在研药物已经陆续开启临床试验阶段,这也意味着中国患者将有获得最新抗癌药物免费治疗的机会。与此同时,“方舟援助计划”也可为患者提供已上市/未上市抗癌新药免费治疗的机会。对现有治疗方案不满意或耐药的患者,可将治疗经历、近期病理及影像学检查报告等资料,提交至医学部,进行初步评估或了解详细的入排标准。
参考资料
[1]Girard N,et al. Phase I/II SOHO-01 study of BAY 2927088 in patients with previously treated HER2-mutant NSCLC: Safety and efficacy results from 2 expansion cohorts[C]//Journal of Thoracic Oncology. STE 800, 230 PARK AVE, NEW YORK, NY 10169 USA: ELSEVIER SCIENCE INC, 2025, 20(3): S5-S6.
https://www.jto.org/article/S1556-0864(25)00198-4/fulltext
[2]Li C,et al.Bispecific CS1-BCMA CAR-T cells are clinically active in relapsed or refractory multiple myeloma. Leukemia. 2024 Jan;38(1):149-159.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10776387/
[3]https://www.onclive.com/view/q4-2025-10-fda-decisions-to-watch-in-the-realm-of-oncology


































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城