内卷升级!国产多款Claudin18.2药物获批临床,持续发力
Claudin18.2(CLDN18.2)是Claudin蛋白质家族的一员,位于细胞膜表面,正常情况下仅低水平表达于胃粘膜分化上皮细胞,但在病理状态下,Claudin18.2在多种肿瘤中有的表达显著上调,包括80%的胃肠道腺瘤、60%的胰腺肿瘤。此外,CLDN 18.2活化还可见于食管癌、卵巢癌和肺腺癌中,因此是具有潜力治疗癌症的热门靶点。
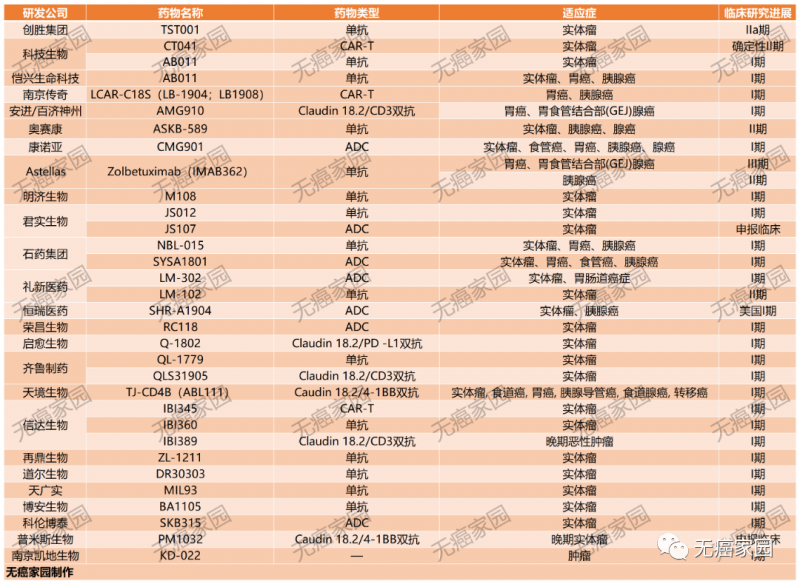
据无癌家园小编查阅ClinicalTrials及CDE(国家药监局)发现,目前批准临床的Claudin18.2产品就多达几十款,多数药物均是拟用于治疗晚期胃癌、胰腺癌及实体瘤患者。
因该靶点在正常组织中的高度特异性表达,再加上在多种癌症中的激活表达,使得Claudin18.2蛋白成为了研究人员开发胃癌、胰腺癌等实体瘤免疫疗法的理想靶点。同时,由于胃癌是国内的一大瘤种,Claudin 18.2靶点有望实现胃癌新靶点药物的瓶颈突破。
目前,已经开发出用于癌症免疫治疗的靶向CLDN18.2 的不同治疗剂,包括单克隆抗体、双特异性抗体 (BsAb)、重定向至靶向 CLDN18.2 的嵌合抗原受体 T (CAR-T) 细胞和抗体-药物偶联物 (ADC)。
Claudin18.2靶点的结构特点✦
表面高表达:Claudin18.2 是一种细胞膜蛋白,其在肿瘤细胞表面高表达。这种高表达使得 Claudin18.2 成为一种理想的靶点,可以用于针对肿瘤细胞的药物研发。
特异性结构:Claudin18.2 具有特异性的结构特点,使得药物能够与其发生特异性的结合。这种特异性结合可以通过单克隆抗体、双特异性抗体、CAR-T细胞等方式实现,从而针对 Claudin18.2 的高表达肿瘤细胞进行精确的治疗。
细胞间连接作用:Claudin18.2 属于细胞间连接蛋白家族,它参与了细胞间连接的形成和维持。这种细胞间连接的作用使得 Claudin18.2 在肿瘤细胞的生长、扩散和转移中发挥重要的作用。因此,针对 Claudin18.2 的药物研发可以通过干扰细胞间连接来抑制肿瘤细胞的活动。
Claudin18.2发挥作用机制✦
细胞间连接的调节:Claudin18.2参与了细胞间连接的形成和维持,通过与其他细胞膜蛋白相互作用,形成了细胞间连接的复杂网络。在肿瘤中,Claudin18.2的高表达可以促进肿瘤细胞与周围细胞的黏附和相互通讯,从而影响细胞的生长、扩散和转移。
促进肿瘤细胞增殖:Claudin18.2 的过度表达可能通过激活相关信号通路,如PI3K/Akt、MAPK等,促进肿瘤细胞的增殖。这可能是由于Claudin18.2参与了细胞增殖相关的信号传导过程,进一步刺激肿瘤细胞的增殖和生存。
促进肿瘤细胞转移:高表达的Claudin18.2可以改变肿瘤细胞的黏附性和可塑性,增加其转移和浸润的能力。通过调节细胞间连接和细胞极性,Claudin18.2可能促进肿瘤细胞的转移和侵袭,增加肿瘤的恶性程度。
靶向Claudin18.2治疗临床研究现状✦
虽然目前还没有药物获得批准,但针对 Claudin18.2 的多个药物正在进行临床试验,并展示出很好的前景。根据 clinical trial 网站登记的数据,截至 2022 年 12 月,全球在研的 Claudin18.2 相关项目已经多达 56 个,与国内公司相关的占比近 80%。
Claudin18.2的药物研发类型✦
单克隆抗体、双特异性抗体、CAR-T细胞疗法、ADC。
单克隆抗体✦
Zolbetuximab是第一个针对Claudin18.2的单克隆抗体,能与肿瘤细胞表面的Claudin18.2结合(但结合的亲和力较低,难以覆盖Claudin18.2 低表达人群)。通过引发细胞介导的细胞毒性作用、补体依赖的细胞毒作用和细胞凋亡,抑制肿瘤细胞增殖。Zolbetuximab联合化疗可显著延长晚期胃癌患者的中位生存期(13.2 vs 8.4个月),并降低 49%的死亡风险。尤其在 Claudin18.2 高表达的亚组中,对于 OS 的改善更加明显(16.6 vs 9.3 个月),死亡风险降低 56%。2022 年 11 月 16 日,安斯泰来宣布了Ⅲ期 SPOTLIGHT 临床试验达到主要终点,研究结果证明,Zolbetuximab 联合 mFOLFOX6对比单纯化疗,对 Claudin18.2 阳性、HER2 阴性晚期胃癌的 PFS 和 OS 有积极影响。基于此,Zolbetuximab 有望成为全球首款上市的 Claudin18.2 单抗。
TST001是第二款针对Claudin18.2的单克隆抗体,具有更高的结合亲和力和与NK细胞更好的结合效率,而且TST001 降低了 Fc 区域的岩藻糖含量,进一步增强了它与 NK 细胞上 Fc 受体的结合能力。若 TST001 最终能够覆盖到中、低表达患者,将会成为超越 Zolbetuximab 的一大优势。今年欧洲肿瘤内科学会年会(ESMO)大会上也公布了TST001 联合 XELOX 作为晚期胃癌一线治疗的Ⅰ期临床研究剂量递增部分的试验结果,并观察到良好的耐受性及初步抗肿瘤活性。
而且 Zolbetuximab目前有胃癌和胰腺癌两个适应证正在开发,而创胜在这两者基础上,还进一步探索了TST001 在胆道肿瘤等其他消化道肿瘤方面应用的可能性。两者均已开始了联合PD-1用于胃癌一线的全球临床试验
还有其他针对Claudin18.2的单克隆抗体,如ASKB585、M108、MIL93、AB011、NBL-015、LM-102。
CAR-T细胞治疗✦
CAR-T细胞治疗是一种已在血液系统恶性肿瘤中取得突破性进展的治疗方法,但靶点选择的困难、实体瘤的高度异质性、免疫抑制的微环境仍然是阻碍CAR-T 细胞治疗在实体瘤成功应用的关键因素。然而,Claudin18.2的特异性表达为CAR-T细胞治疗提供了一个强大的靶标抗原,为实体瘤领域带来了重大突破。
科济药业的CT-041的CAR-T细胞治疗在Nature Medicine上的数据已经显示出在二线及以上的消化系统肿瘤中 ORR达到 48.6%,胃癌的 ORR 高达 61.1%,DCR 为 83.3%,中位 PFS 和 OS 分别为 5.6 个月和 9.5 个月,在接受过 PD-1/PD-L 单抗的患者中也显示出较好的疗效,并且未出现 3 级及以上的细胞因子释放综合征,整体安全性可控。目前,CT-041 针对晚期胃癌/胃食管胃结合部腺癌的研究,已经处于确证性Ⅱ期临床试验。若后续临床数据优异,CT-041 也将有潜力成为晚期胃癌末线治疗的主力疗法。
与其他 CAR-T 细胞治疗一样,细胞因子释放综合征是最主要的潜在不良反应,使其临床应用具有一定的挑战性,新一代 CAR-T 细胞治疗将结合基因工程与合成生物学的进步,以增强疗效的持久性,并减少与治疗相关的毒性。许多公司已经开始布局新一代 CAR-T 及异体 CAR-T 技术。例如,为了提升 CAR-T 细胞在实体瘤中的浸润、积累和生存,科济公司基于 Cyclo CAR-T 技术开发了表达 IL-7 和 CCL-21 细胞因子的 CAR-T 细胞(7×21 CAR-T),有可能提高临床疗效并降低对淋巴细胞清除的需求。临床前研究表明,IL-7 可以增强 CAR-T 细胞增殖和存活,抑制 CAR-T 细胞凋亡,CCL-21 可驱动 T 细胞和树突状细胞浸润到肿瘤部位,提高抗肿瘤作用。CycloCAR-T 细胞(7×21CAR-T)与传统 CAR-T 相比,可以改善对小鼠实体瘤的治疗效果,甚至诱导肿瘤完全缓解。此外,隆耀生物、传奇生物、北恒生物开发的靶向 Claudin18.2 的下一代 CAR-T 细胞治疗均已经进入临床 I期试验,用于治疗胃癌或胰腺癌。期待新的技术突破能进一步优化 CAR-T 疗法在实体瘤中的应用。
双特异性抗体✦
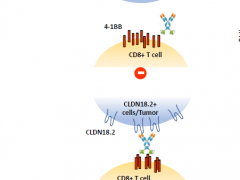
双特异性抗体也是一种针对Claudin18.2的治疗方法,其作用机制包括聚集/定位免疫细胞、免疫细胞激活和阻断信号通路。目前已经进入临床试验的双特异性抗体包括Claudin18.2/CD3、Claudin18.2/4-1BB、Claudin18.2/PD-L1和Claudin18.2/CD47 。这些双特异性抗体相比单克隆抗体具有更强的特异性和更低的脱靶毒性,对胃癌和胰腺癌的治疗具有潜力。
2020 AACR 年会上公布了全球首个 Claudin18.2/PD-L1 双特异抗体 SPX-301 临床前数据,SPX-301 与 Claudin18.2、PD-L1 结合力、免疫原性和聚合性都与单抗类似,但在细胞试验中显示优于单抗的功能活性。2021 年 3 月 4 日,启愈生物的 Q-1802 成为国内首个申报临床的 Claudin18.2/PD-L1 双特异性抗体,2022 ASCO 大会报告了 Q-1802 的安全性,并显示出初步疗效。
安进/百济神州的AMG 910为靶向CLDN18.2和CD3的双特异性T细胞接合剂(BiTE)分子,是首个进入临床的 Claudin18.2/CD3 双抗,目前正在全球处于胃癌或胃食管交界处癌的Ⅰ期临床阶段。但相比单克隆抗体,双抗药物开发的复杂性和技术壁垒更高,因此,对技术平台和靶点选择的要求也有所提高,细胞因子释放综合征(CRS)等安全性问题也是药物研发需要解决的关键问题。国内信达公司的IBI389(NCT05164458)以及齐鲁制药的QLS31905(NCT05278832)也有类似药物正在Ⅰ期临床试验阶段。
ADC✦
ADC是近年来受关注的研究领域之一。康诺亚生物的 CMG901,是全球首个Claudin18.2 ADC,CMG901是由靶向 Claudin18.2的人源化单抗CM311和微管聚合蛋白抑制剂MMAE通过可裂解连接臂偶联而成的ADC。临床前数据显示,CMG901在疗效和耐受性方面均优于裸抗。另外,荣昌、石药、恒瑞、礼新医药等均在靶向Claudin18.2 的 ADC领域不断探索,目前正在开展Ⅰ/Ⅱ期临床研究。
相比单克隆抗体,ADC的最大潜在优势在于可能通过“旁观者效应”在 Claudin18.2 低表达人群中实现突破,此外,单抗治疗失败的患者能否从ADC中获益成为药物研发的关键。未来一方面应重点关注其获益人群,开发伴随诊断,同时ADC药物相关的特殊副作用的管理,例如眼毒性等也需要做好相应管理。
靶向 Claudin18.2 治疗面临挑战✦
药物定位和适应证的选择:每种靶向Claudin18.2的药物都需要找准自身的优势和定位,合理开发适应证,并形成差异化竞争策略。精准定义Claudin18.2阳性并筛选出获益人群是其中的关键问题。
药物相关不良反应的管理:对于靶向 Claudin18.2的药物,管理与其相关的不良反应是必须解决的关键问题之一。
覆盖低表达人群和治疗失败患者:目前已有的药物如Zolbetuximab尚难以覆盖Claudin18.2低表达的患者以及单克隆抗体治疗失败的患者。因此,双特异性抗体和ADC等新型药物有望解决这一问题。
靶点筛查和精准诊断:目前靶向 Claudin18.2的药物开发多以免疫组化为基础,但不同的研究所采用的检测抗体和纳入的患者人群存在差异,导致 Claudin18.2 的阳性率存在差异。因此,开展精准诊断并采用多维度的筛查方法对 Claudin18.2阳性患者至关重要。
不同药物类型面临的挑战✦
CAR-T细胞治疗:有细胞因子释放综合征(CRS)等不良反应的风险,可能导致严重的炎症反应和组织损伤,因此需要有效的管理策略。
双特异性抗体:开发双特异性抗体相对复杂,需要克服抗体工程、制备和稳定性等方面的挑战。确保双特异性抗体的高亲和力和选择性,并且能够稳定地在体内发挥作用。
ADC:特殊副作用的管理,例如毒性药物的释放可能导致与靶细胞无关的组织损伤。确保ADC的稳定性和适当的释放机制,以实现最佳的抗肿瘤活性。
尽管存在这些挑战,目前的临床研究正在积极改变 Claudin18.2 阳性消化系统肿瘤的治疗模式,各种靶向Claudin18.2的药物正在竞争中崭露头角。靶向 Claudin18.2 的临床和转化研究仍然有广阔的探索空间。
紧急通知!如果您有相关基因靶点突变,例如有
EGFR/ALK/NTRK/HER2/claudin18.2/等靶点突变,
请速联系我们,为您申请临床新药,获取营养补助等
2. 备注【癌种】

患者咨询电话:400-666-7998





适合患者:NTRK1/2/3、ROS1或ALK基因重排突变的实体瘤
适合患者:只要存在NTRK融合,不限癌种
适合患者:晚期恶性实体瘤
适合患者:NTRK基因融合
适合患者:标准治疗失败或无标准治疗方案的晚期实体肿瘤患者
适合患者:晚期或转移性实体瘤
适合患者:晚期实体瘤患者

全球肿瘤医生网不具备药品销售资格,不售卖任何药物,也不帮助患者代购药物。网上药品代购存在假药等风险,且代购均为违法行为,请广大患者做好自我保护。

适应症:...