胆管癌免疫治疗药物,胆管癌靶向治疗药物千帆竞发,前景可期
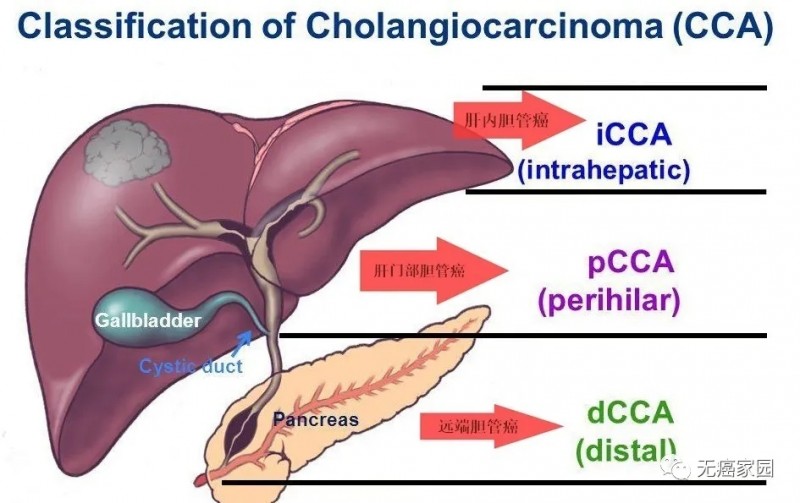
胆管癌是一种起源于胆管上皮细胞的恶性肿瘤,根据解剖部位,胆管癌可分为肝内胆管癌(iCCA)、肝门部胆管癌(pCCA)、远端胆管癌(dCCA)。复旦大学附属中山医学副院长周俭教授指出,肝内胆管癌发病率约占原发性肝脏恶性肿瘤的15~20%,且呈上升趋势。
虽然手术是唯一具有无进展生存潜力的治疗方式,但是大部分肝内胆管癌患者初次就诊时常伴有局部侵犯或远处转移而失去手术根治机会。即使有幸采取根治性切除手术,患者的复发率仍较高,不能手术切除或晚期胆管癌患者目前已有的系统治疗疗效较差,标准治疗(顺铂联合吉西他滨的化疗方案)被推荐为晚期胆管癌的一线治疗方案,客观缓解率(ORR)为15~26%,且常发生耐药。因此,开发合适的靶向、免疫药物及疗法成为解决胆管癌患者的重中之重。近年来,胆管癌的靶向及免疫治疗也在稳步进行中,下面小编将对此进行汇总。
提前获批!胆管癌史上首款靶向药闪亮登场!
有研究表明,在胆管癌中约有40%的患者存在潜在的可靶向性的基因突变,具有靶向治疗的可能。胆管癌患者主要突变基因有KRAS、BRAF、FGFR2、IDH1/2等,其中较为重要的是FGFR2突变。
就在2020年4月17日,胆管癌患者迎来了一个重磅好消息!FDA加速批准Incyte公司Pemazyre(pemigatinib),用于治疗既往接受过治疗的携带成纤维细胞生长因子受体2(FGFR2)融合或重排的局部晚期或转移性胆管癌患者,批准时间比预定的5月30日审批日期提前了一个半月,这也是FDA批准的首个胆管癌靶向疗法。
关于FGFR2基因融合/重排
成纤维细胞生长因子受体(FGFR)在肿瘤细胞增殖、存活、迁移和血管生成(新血管的形成)中发挥着重要作用。FGFR基因融合/重排、易位和扩增极可能导致多种癌症的发生。在胆管癌中,目前的研究已证实FGFR2基因融合/重排可促进肿瘤的发生和发展,靶向FGFR2对存在此类FGFR2变异的胆管癌具有明显的治疗作用。
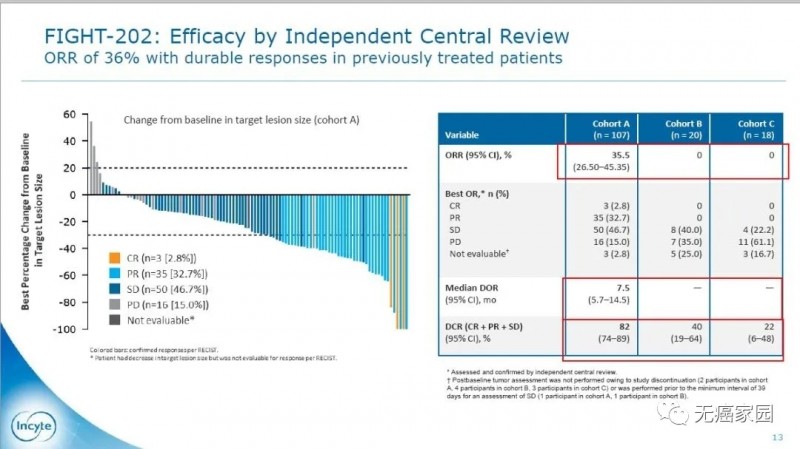
Pemigatinib是针对FGFR亚型1/2/3的强效选择性口服抑制剂,在既往临床研究中已证实该药物对FGFR基因突变的肿瘤细胞具有选择性的药理学活性。此药二线治疗胆管癌患者的无进展生存率ORR达35.5%,疾病控制率DCR为82%,成为胆管癌历史上第一个靶向药物!具有划时代的意义!
靶向FGFR的药物pemigatinib在前期FGFR2基因融合或重排胆管癌患者中的临床研究显示,该靶向药物对晚期胆管癌患者具有显著的疗效,且安全性好。该研究共纳入146例经过≥1线治疗的晚期胆管癌患者,分为3个队列:A是FGFR2融合/重排(107例),B是其他FGFR突变(20例),C是非FGFR突变(18例),1例患者未定。所有患者均接受Pemigatinib治疗(13.5mg,每天1次,用2周歇1周)。
结果显示,A组客观缓解率(ORR)为35.5%,其中3例(2.8%)患者完全缓解(CR),35例(32.7%)患者部分缓解(PR),50例(46.7%)患者疾病稳定,疾病控制率为82%。B组和C组的ORR为0%。相比其他两个队列,队列A的患者对药物有效响应的比例大很多,有效时间也长得多。
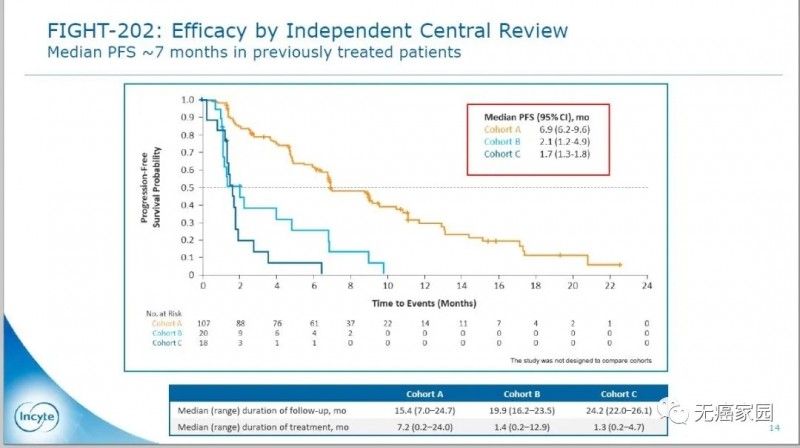
A组的DOR中位数为7.5个月,PFS和OS中位数分别为6.9和21.1个月。相比其他两个队列,生存期得到大幅度延长,意味着的患者用Pemigatinib治疗效果非常不错。
在安全性方面,pemigatinib最常见(≥20%)的不良反应包括电解质紊乱(高磷血症和低磷血症)、脱发、腹泻、指甲毒性、疲劳、消化不良(味觉失灵)等,其不良事件的发生率和其他选择性FGFR抑制剂类似,整体上耐受性好,毒副作用可控。
FGF/FGFR通路的异常激活可以使肿瘤细胞以“自给自足”的方式维持生长,所以FGFRs成为肿瘤治疗的新靶点。临床数据显示,胆道癌中有13%~20%的患者携带FGFR2融合。
值得庆幸的是,FDA在同一天批准FoundationOne CDx作为唯一用于pemigatinib的伴随诊断。
因此,胆管癌患者若想要采用pemigatinib治疗首先需要确定是否携带FGFR2基因突变,想要进行基因检测的癌友们详情可以咨询全球肿瘤医生网医学部,若是做过基因检测的癌友可以将检测报告提交给医学部进行病情评估。
相关文章:重磅!提前获批!胆管癌史上首款靶向药Pemigatinib闪亮登场!
锦上添花!FDA指定FoundationOne CDx为首款靶向药Pemigatinib的伴随诊断
不服不行!全球肿瘤基因检测行业标杆-Foundation Medicine!
DCR达83.6%,FGFR抑制剂infigratinib成为新选择
Infigratinib(BGJ398)是一种口服给药的选择性FGFR酪氨酸激酶抑制剂。2020年1月,FDA根据2018年ESMO大会上首次公布的II期临床试验的结果,授予Infigratinib 治疗一线晚期或转移性一线成人胆管癌患者的快速通道称号。
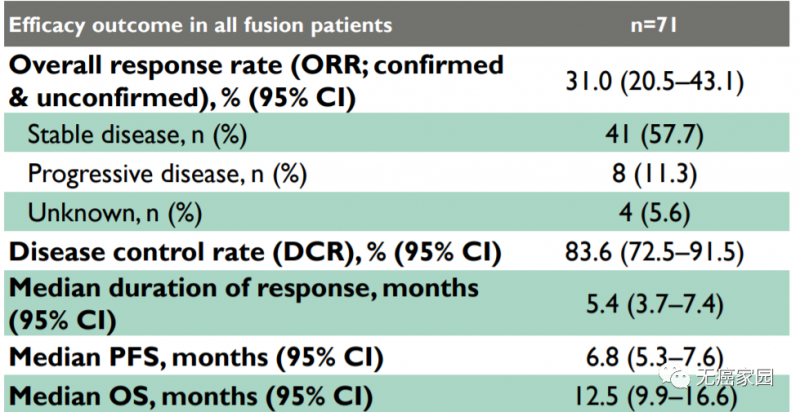
在开放标签试验中(NCT03773302),共招募了71例患有FGFR2融合/重排的患者。试验结果显示,所有FGFR2融合阳性患者的客观缓解率ORR(确认和未确证)为31.0%,疾病控制率(DCR)为83.6%。中位无进展生存期(PFS)为6.8个月,中位总生存期(OS)为12.5个月。
全球肿瘤医生网的专家点评道,这些更新的数据为FGFR抑制剂在晚期胆管癌中提供了广泛经验,infigratinib具有高疾病控制率和令人印象深刻的总生存率,预计infigratinib可以对胆管癌患者产生真正的影响。
无进展生存期翻倍!双药免疫组合疗法前景可期!
少数胆管癌患者在其肿瘤中存在错配修复缺陷(MMR-d),而约翰·霍普金斯金梅尔癌症中心的研究人员此前发现,使用PD-1抑制剂帕博利珠单抗(K药)进行免疫治疗,可以有效地治疗有MMR-d的肿瘤。
MMR-d的特征是修复DNA复制错误的基因发生大量突变,而这已被证明能引起免疫细胞对癌症产生反应,可作为PD-1免疫治疗的生物标志物。然而,大多数胆管癌患者肿瘤中并没有任何可作为治疗靶点的突变,这意味着,他们患的是一种典型的高度免疫抵抗性癌症。
因此,在刚刚落幕的2020年美国癌症研究协会(AACR)虚拟年会上,来自约翰·霍普金斯金梅尔癌症研究中心肿瘤学副教授等研究者公布了一项II期临床研究,采用阿替利珠单抗(Atezolizumab)+考比替尼(Cobimetinib)的联合免疫疗法,结果表明,与单用阿替利珠单抗相比,阿替利珠单抗+考比替尼联合疗法治疗胆管癌达到了其主要终点并显著延长了无进展生存期。

该研究选取86例晚期胆管癌患者,此前可能已接受一两次胆管癌治疗。结果显示,联合治疗组的无进展生存期几乎是单药治疗组(57天)的2倍(111天),无进展生存期的差异也达到了主要终点。
联合治疗组的疾病控制率(DCR)为45.2%(14/31),在单药治疗组中位32.4%(11/34)。2例接受联合治疗的患者,在研究开始后超过15个月仍有效!
【免疫药物“双星”介绍】
阿替利珠单抗(商品名:泰圣奇Tecentriq)是一种PD-L1抑制剂,可以通过与PD-L1结合,阻断肿瘤细胞对T细胞的抑制作用,让免疫T细胞继续杀伤肿瘤细胞。
考比替尼(Cobimetinib)是一种MEK抑制剂,可阻断MAP激酶通路,在细胞周期调控中起重要作用。尽管MEK抑制剂单药用于胆管癌的活性有限,但它们可以改变肿瘤微环境,使其更适合于免疫治疗。临床前模型显示,MEK抑制剂与PD-L1抑制剂联用,可获得持久的抗肿瘤免疫作用。
最后,小编期待这种免疫联合疗法的进一步研究能够取得积极的结果,早日获批,为胆管癌患者带来新的治疗选择!
国内靶向及免疫疗法正在临床招募中
项目一
上述小编盘点了国际上关于胆管癌的研究进展,国内的临床研究也在如火如荼地进行中。目前有一项在中国晚期实体瘤患者中开展的EOC317片口服给药的I期临床研究正在进行中,主要招募的癌种不仅仅局限于胆管癌,还有膀胱癌、胃癌、乳腺癌等。如果您是符合下述标准的患者,可以尝试联系医学部评估是否能够入组。
项目二
除了靶向药物的临床试验外,也可以选择TILs免疫疗法。国内有一项TILs疗法治疗原发性胆道系统恶性肿瘤的临床研究也正在招募中,感兴趣的患者也可以联系小编。
试验目的:观察和评估ScTIL-v2治疗原发性胆道系统恶性肿瘤的耐受性、药代动力学特征,以及安全性和有效性。
入组条件(部分)
1. 年龄≥18岁且≤70岁,性别不限;
2.预期自然存活3个月以上者;
3.组织学或细胞学证实的局部晚期或转移性胆道肿瘤患者;
4.既往治疗失败或已经放弃放化疗,自愿接受细胞治疗的患者
5.签署知情同意书。
小编有话说
最后,小编再次很负责任地向癌友们提出忠告,不管是咨询临床试验还是进行基因检测都要到正规且的医疗机构,选择的国内外专家进行咨询!力求让越来越多的癌友在治疗过程中少走弯路,尽快从癌症的阴霾中解脱出来!
参考文献
1.https://www.fda.gov/news-events/press-announcements/fda-approves-first-targeted-treatment-patients-cholangiocarcinoma-cancer-bile-ducts
2.https://www.onclive.com/web-exclusives/fda-approves-foundationone-cdx-as-pemigatinib-companion-diagnostic-in-emfgfr2em-cholangiocarcinoma
3.https://www.firstwordpharma.com/node/1598708#axzz5UXJIsme7
4.https://ascopost.com/news/may-2020/atezolizumab-alone-or-in-combination-with-cobimetinib-for-biliary-tract-cancer/







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城