实体瘤CAR-T细胞治疗,新型CAR-T细胞疗法有望针对多种靶点攻克消化系统肿瘤
消化系统肿瘤具有高发病率、高病死率的特点。在我国的肿瘤谱中,消化系统肿瘤占50%以上。对于消化系统肿瘤,目前最有效的手段是手术,但是一旦缺乏手术指征,就几乎没有特别有效的治疗手段。因此,亟需发展新型的治疗手段来解决这一难题。
嵌合抗原受体修饰T细胞(CAR-T)无疑是最令人期待的治疗手段之一。这项技术近年来在治疗各种恶性肿瘤方面取得了巨大进展,已成功应用于多种血液恶性肿瘤的治疗。此外,在实体肿瘤方面如消化系统肿瘤领域也取得了一定的疗效,包括食管癌、胃癌、肝癌、结直肠癌、胰腺癌、胆管癌等。其中,胰腺癌和胆管癌是致命的癌症,5年生存率很低,由于传统的治疗方法不能显著提高患者的生存率,因此,CAR-T疗法是近年来研究的热点,关于这些癌症的不同靶点正在研究中。
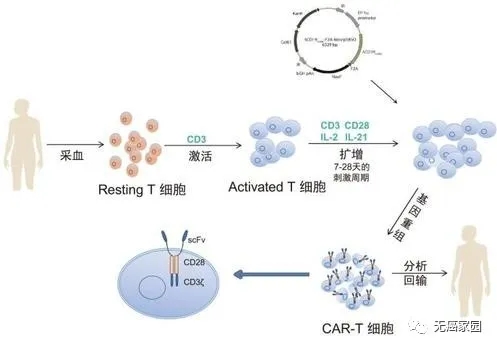
小编今天就对CAR-T细胞治疗消化系统肿瘤的临床试验数据作一总结,以了解其安全性和有效性。
肝癌CAR-T细胞治疗
1、晚期肝癌也有救!国人专属CAR-T临床试验再现曙光
据统计,我国原发性肝癌的发病和死亡例数占比分别占全球的54.6%和53.9%,更不幸的是,我国每年死于肝癌的约34.4万人,占世界肝癌死亡人数的55%,每一分多钟就会有一人死于肝癌。
相对于高死亡率,早期肝癌的发现比例却非常低,9成以上一经发现就已是晚期,此时已失去了手术治疗的机会,致使5年生存率仅为12%,中晚期肝癌患者的5年生存率更是低至3%。当前应用CAR-T治疗肝癌的临床试验靶点主要是GPC3(磷脂酰肌醇蛋白多糖3。
这项突破性的研究成果发表在5月5日的国际权威期刊《Clinical Cancer Research(临床肿瘤研究)》上,在两项前瞻性I期研究中,患有晚期GPC3 + HCC的成年患者(Child-Pugh A)在环磷酰胺和氟达拉滨诱导的淋巴清除后接受了自体CAR-GPC3 T细胞疗法。主要目的是评估治疗的安全性。
截止到2019年7月24日,共有13例患者接受了中位值为19.9×108的CAR-GPC3 T细胞。所有患者均为GPC3阳性,均接受过手术治疗、局部治疗或全身性的系统治疗,都携带乙型肝炎病毒(HBV)。
其中有2例患者获得部分缓解(PR),所有患者6个月、1年和3年的生存率分别为50.3%、42.0%和10.5%,中位生存时间(OS)为278天(39.7周)。
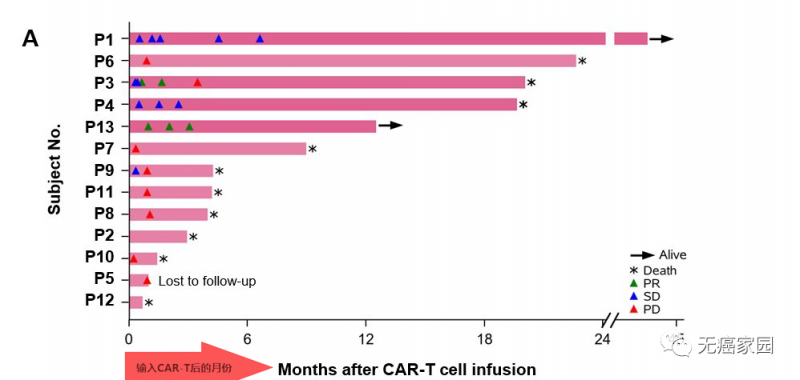
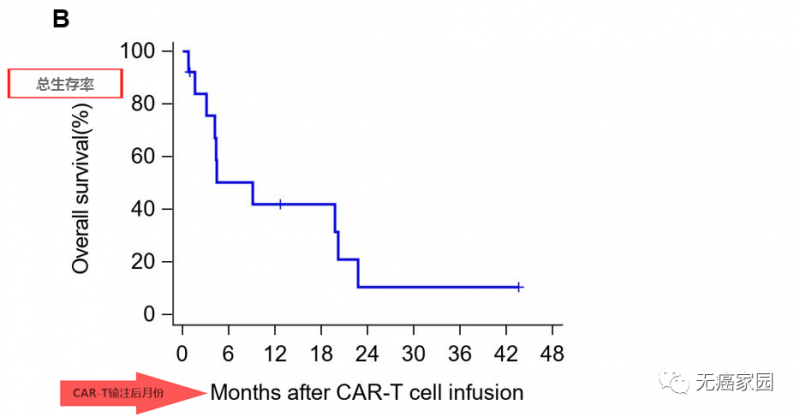
典型病例
这两例患者生存时间分别是20.5个月(图P13)和44.2个月(图P3),其中一例疾病稳定的患者至今生存期将近4年,他在入选时已有下腔静脉癌栓、右心房癌栓以及淋巴结转移,治疗后AFP(甲胎蛋白)长期维持正常水平且长期生存。
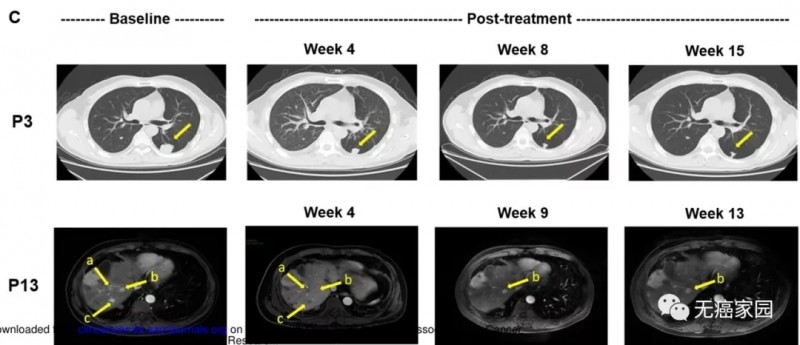
无癌家园专家认为,该研究结果表明GPC3 CAR-T具有很好的安全性,并且展示了初步的有效性,很有可能成为肝细胞癌的新型治疗手段。
胃癌CAR-T细胞治疗
据全国肿瘤登记中心最新数据估计,胃癌位居同期恶性肿瘤发病第2位。其整体预后较差,5年生存率仅10%~30%,晚期胃癌患者5年生存率低于10%,晚期胃癌一线治疗的研究结果显示,总生存期(OS)在不断延长,但中位生存期仍在12个月左右。
为了提高胃癌的生存率,全世界范围内已广泛开展免疫治疗。目前,已经发现了一些胃癌的肿瘤标志物,并对这些标志物进行了广泛的研究。当前应用CAR-T治疗胃癌的临床试验靶点包括EpCAM、CEA、MUC1、HER2和MG7。
1、EpCAM(上皮细胞黏附分子)
EpCAM是一个过表达在多种肿瘤的跨膜糖蛋白,被认为是一种潜在的肿瘤干细胞标志物,有超过90%的胃癌过表达EpCAM,但是EpCAM也表达于胰腺等组织,所以针对EpCAM的单克隆抗体在临床中可引发胰腺炎,故针对EpCAM的CAR-T必须注意这样的风险。
2、CEA(癌胚抗原)
CEA最初发现于结肠癌和胎儿肠组织中,后被证实广泛存在于内胚叶起源的消化系统肿瘤,比如胃癌、肝癌、胰腺癌、结直肠癌。一项临床前研究显示,靶向CEA的CAR-T细胞可以诱导胃癌细胞发生凋亡。
3、MUC1(黏蛋白1)
MUC1是一种跨膜黏蛋白,广泛过表达在胃癌、肝癌、胰腺癌,目前已经广泛开展了抗MUC1的CAR-T治疗临床试验。
4、HER2(CerbB-2、ERBB2、人表皮生长因子受体2)
Her2在大约10%的胃癌中过表达,针对Her2的单克隆抗体Herceptin也已经被批准用于Her2过表达的胃癌中。近期临床前研究显示,CAR-T-HER2细胞对HER2+的胃癌细胞具有特异性的杀伤效果。
5、MG7
MG7是一种癌胚抗原的糖基化蛋白,是一种具有高特异性和敏感性的胃癌相关性抗原。目前有使用MG7靶点对胃癌进行治疗的临床试验。另外,也已经有关于MG7-CAR-T肝转移癌的临床研究正在进行。
胰腺癌CAR-T细胞治疗
1、"老树生新花",改良GoCAR-T技术数据惊艳
在2019年6月召开的美国临床肿瘤学会(ASCO)年会上,Bellicum Pharmaceuticals公司公布了一项针对表达前列腺干细胞抗原(PSCA)的转移性胰腺癌患者的1/2期临床试验数据。该公司研制的一种新型的改良GoCAR-T技术——BPX-601,其安全性和活性数据都相当积极。迄今为止,BPX-601的耐受性良好,剂量限制性毒性未观察到。
与BPX-601相关的大多数不良事件为轻度至中度,给予或不给予支持性治疗均可得到缓解。
尽管临床试验设计相对保守,但在研究初期已观察到激发生物活性的证据!在13例可评估疗效的患者中,8例(62%)病情稳定,有3例患者的肿瘤缩小10%~24%。
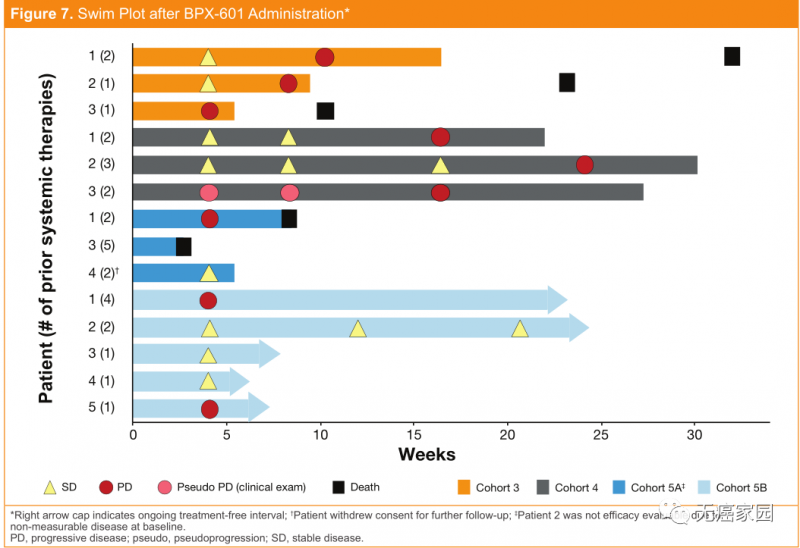
BPX-601给药后各个患者的疗效情况
这家公司董事长兼执行官Rick Fair先生表明这种疗法在设计上更为有效,有望突破传统的CAR-T的局限性,更好地应对实体瘤。
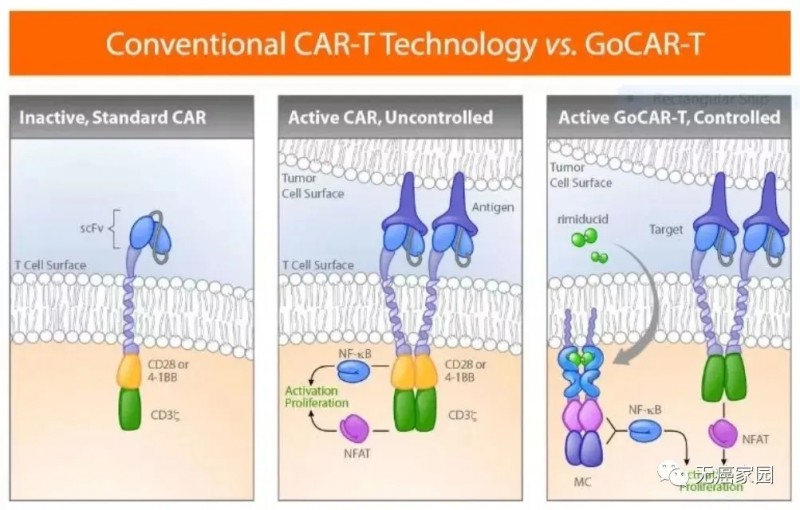
GoCAR-T技术让CAR-T细胞只有在小分子药物存在时才会被激活
尽管胰腺癌是块难啃的“硬骨头”,但研究人员对此表示有充足的信心。在谈到未来的发展规划时,Rick Fair先生表示将继续推进胰腺癌的相关研究,并计划将该研究扩大到包括其他表达PSCA的肿瘤。其他研发管线的候选药物还包括BPX-603(一款结合了诱导型MC激活开关及CaspaCIDe安全开关、靶向HER2的CAR-T细胞产品)、BPX-802(双开关GoCAR-T)等。
除了上述报道的国际CAR-T突破性临床研究外,当前应用CAR-T治疗胰腺癌的临床试验靶点包括CD133、EGFR、EpCAM、MUC1、CEA、HER2、PSCA、mesothelin。若想了解更多CAR-T实体肿瘤的临床研究请持续关注无癌家园(400-626-9916)。
2、中国研发出国际首个靶向Claudin18.2的实体瘤CAR-T疗法
近两年,我们国家的实体肿瘤取得了备受世界瞩目的成绩,研发出了国际上首个靶向Claudin18.2的实体瘤CAR-T疗法。
Claudin18.2(CLDN18.2)是一种胃特异性膜蛋白,被认为是胃癌和其他癌症类型的潜在治疗靶点。基于此,中国研究人员开发了国际上首个针对 Claudin18.2 的 CAR-T 细胞。
2019 ASCO年会上,CAR-Claudin18.2 T 细胞治疗胃癌/胰腺癌的临床数据更新显示,靶向claudin18.2 CAR T细胞治疗12例转移性腺癌(胃癌7例,胰腺癌5例),未发生严重不良事件、治疗相关死亡或严重神经毒性。11例评估对象中:1例(胃腺癌)完全缓解;3例(胃腺癌2例胰腺腺癌1例)部分缓解;5例病情稳定;2例病情进展;总客观缓解率为33.3%。
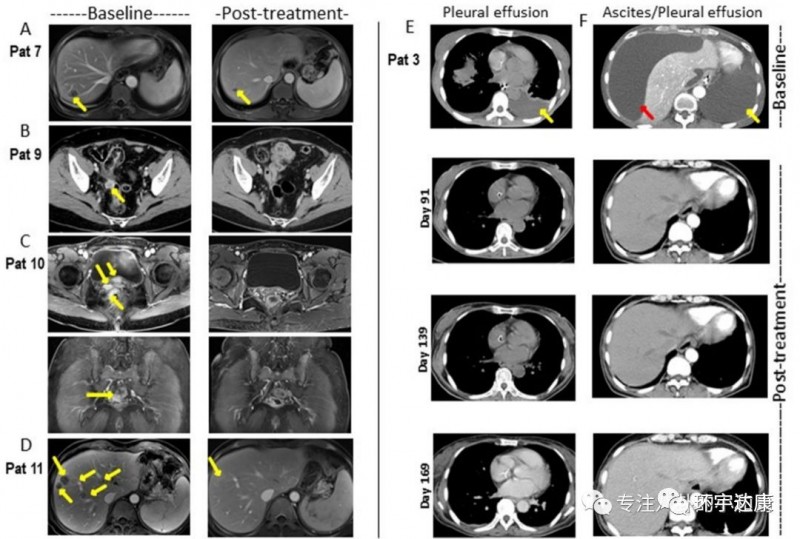
并且,CAR-Claudin18.2 T 细胞治疗胃癌的临床前研究成果显示, 靶向Claudin18.2的CAR-T细胞在小鼠模型中可以完全清除胃肿瘤,且没有发生脱靶毒性。
好消息是,这项试验已经率先由国内胃肠道肿瘤享负盛名的北京大学肿瘤医院胃肠肿瘤科开展,评估自体人源化抗claudin18.2嵌合抗原受体T细胞在晚期实体瘤中的安全性及功效。
入组标准(部分)
年龄18~75岁,男性或女性;
患有病理证实的实体瘤(即晚期胃癌,食管胃交界癌和胰腺癌)并且经标准治疗失败的受试者;
Claudin 18.2 IHC染色阳性;
预计寿命>12周;
食管癌CAR-T细胞治疗
中国每年的食管癌新发和死亡患者数,占全球发病和死亡的一半,是名副其实的食管癌大国。而且在癌症的组织学类型上,中国患者也与欧美有着巨大的差异,90%以上的食管癌患者为鳞癌,而欧美国家鳞癌患者的比例只有50%左右。
通常情况下,患者在初次确诊时,多已为晚期或伴有远处转移,患者的主要治疗手段多为化疗。但化疗治疗的有效率可达40%~60%,但一线治疗失败后的中位生存期仅为5~10个月,5年生存率处于5%的水平停滞不前,临床上迫切地需要新治疗方案的出现。
目前已经有利用以EpCAM、HER2为靶点的CAR-T治疗食管癌的临床研究正在开展。
结直肠癌CAR-T细胞治疗
据2018年中国癌症统计报告显示:我国结直肠癌发病率、死亡率在全部恶性肿瘤中分别位居第3及第5位,其中新发病例37.6万,死亡病例19.1万。
然而不幸的是,多数患者在确诊时已属于中晚期。手术仅作为对患者的姑息治疗方法,或是仅用于消除对患者影响较大的症状,而以辅助治疗为主,一般治疗的预后都不理想。
自从肿瘤免疫治疗成为第四种癌症治疗方法,研究者们逐渐将目光投向近几年来的热门疗法——CAR-T疗法。
小编根据众多临床研究整理出结直肠癌中CAR-T细胞疗法的潜在靶点,主要包括抗4-1BB(ANTI-4-1BB)、癌胚抗原(CEA)、GUCY2C、TAG-72、EpCAM、上皮糖蛋白40(EGP40)、NKG2D、HER-2、重组人干扰素α/β受体1(IFNAR1)、prominin-1(CD133)、上皮糖蛋白2(EGP-2)。
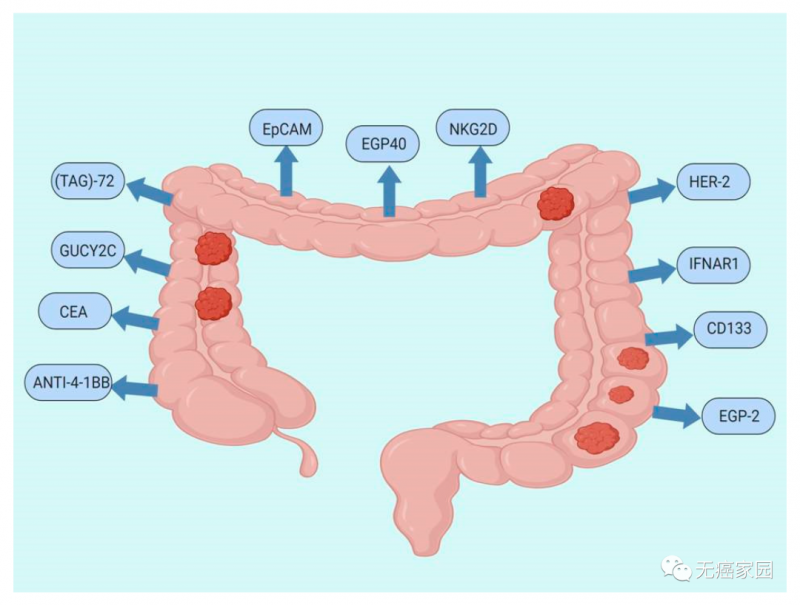
胆管癌CAR-T细胞治疗
胆管癌是起源于胆管黏膜上皮的最致命的恶性肿瘤之一,约占所有消化系统肿瘤的3%,发病峰值为70岁,男性略多于女性。中国胆管癌患者数较多,因而胆管癌研究在我国具有特殊意义。手术切除是所有胆管癌的最佳治疗手段,但由于早期诊断困难,仅10%的患者能够得到手术治疗。胆管癌患者术后5年生存率约5%,未切除胆管癌患者生存期<1年。
胆管癌的临床化疗效果并不理想,近期开展的进展期胆管癌CAR-T靶向治疗临床研究值得期待。目前有临床试验研究显示,一名被诊断为进展性手术不可切除的转移性胆管癌并拒绝放化疗的52岁女性患者,接受了CAR-T鸡尾酒免疫疗法,CAR-T细胞的靶点分别为EGFR和CD133.CAR-T-EGFR治疗后,患者有8.5个月的部分缓解,CAR-T-CD133治疗后,患者持续4.5个月部分缓解。
小编有话说
消化系统肿瘤占人体肿瘤的比例很大,尤其在我国占所有肿瘤的一半左右,因此亟待找到有效针对消化系统肿瘤的治疗手段。针对GPC3、CEA、CD133等靶点的CAR-T细胞为消化系统肿瘤提供了潜在的治疗手段。
总之,小编相信,随着CAR-T细胞的不断衍化,在不久的将来肯定会有更安全更高效的CAR-T细胞成功用于治疗消化系统肿瘤,大大延长患者的生存期!
参考文献
1.http://www.cnki.com.cn/Article/CJFDTOTAL-SMKX201709003.htm
2.https://www.onacademic.com/detail/journal_1000039798132810_8283.html







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城