难治性肿瘤遇上强敌,多款抗体偶联(ADC)药物"化疗联合靶向治疗"玩转肿瘤精准治疗
自2000年第一个ADC药物上市以来,ADC在业界一直不温不火,直到2019年,FDA先后批准了3个ADC药物(Polivy、Padcev和Enhertu),才让曾经沉寂的ADC药物迎来了它的爆发期。据统计,目前已上市的ADC药物已有7个,完成注册的有2个。而此次小编将为大家介绍下这些药物。
精准爆破癌细胞的"生物导弹"——ADC
在介绍ADC药物之前,我们先来认识下什么是抗体偶联药物(ADC)!
抗体偶联药物就像是生物导弹,由两部分核心功能组成:第一是抗体(导弹体),第二是强化疗药(核弹头);这种设计会使抗体带着化疗药去找肿瘤细胞,然后精准地给肿瘤细胞下毒,毒死它们。这种药物设计结合了靶向药的精准和化疗药的高效,既避免了全身使用化疗药的毒副作用,也比单独使用靶向药具有更强的杀伤能力,一举两得。
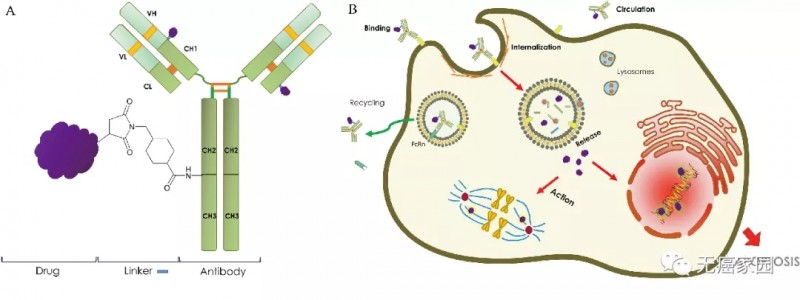
抗体偶联药物示意图注:(A)ADC结构的一般描述;(B)ADC的作用机制
近年来ADC药物发展迅猛,作为最早获批应用ADC药物的实体瘤,ADC药物在乳癌治疗上迅猛发展并占据乳癌治疗的半壁江山。其中说起DS-8201可谓是实力超群,虽然以后线治疗起家,但临床数据遍布乳腺癌、胃癌、肺癌、结直肠癌,给多癌种HER2突变患者带来了新的治疗希望,展现出非凡的潜力!
靶向四大癌种!广谱王牌新药DS-8201风头正盛
DS8201,一种HER2抗体+伊立替康类化疗药物的偶联药物,属于ADC型药物类型(抗体偶联药物)。它有两部分组成:第一部分是针对HER2靶点的抗体,可以精准的识别并且结合HER2高表达甚至低表达的肿瘤细胞;第二部分是剧毒的化疗药伊立替康。这种设计会使抗体带着化疗药去找肿瘤细胞,然后精准地给肿瘤细胞下毒,毒死它们。
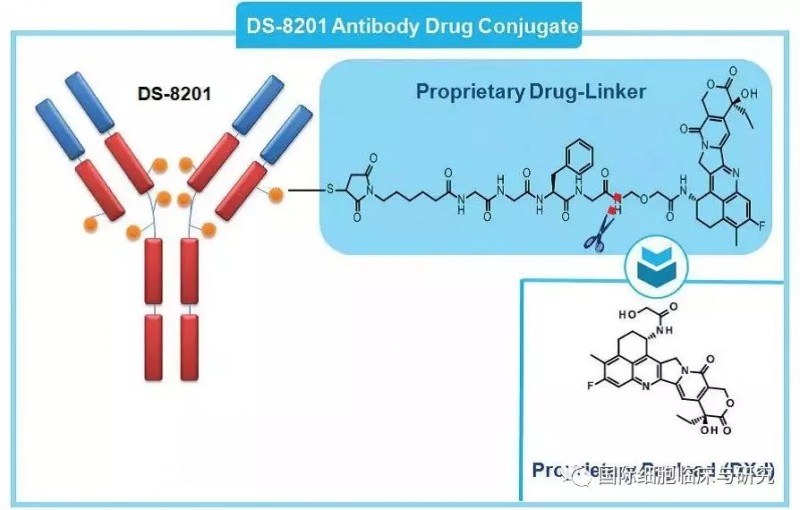
图为DS-8201的设计结构,图中橙色小圆球为化疗药(来源dsi.com)
这种药物设计结合了靶向药的精准和化疗药的高效,既避免了全身使用化疗药的毒副作用,也比单独使用靶向药具有更强的杀伤能力,一举两得。
01、客观缓解率达60.9%,DS-8201强势逆转乳腺癌病情
DESTINY-Breast01临床试验旨在评估DS-8201用于先前接受过曲妥珠单抗-美坦新偶联物治疗的HER2阳性不可切除和/或转移性乳腺癌患者的安全性和疗效。
针对184例HER2阳性的乳腺癌患者在接受推荐剂量5.4 mg/kg后,客观缓解率(ORR)为60.9%,包括11例患者肿瘤完全消失,疾病控制率为97.3%,临床获益率为76.1%,中位缓解持续时间(DoR)为14.8个月,中位无进展生存期(PFS)为16.4个月。试验尚未达到患者中位总生存期(OS),患者1年生存率估计为86%。
02、疾病控制率达83%,DS8201击破HER2阳性结直肠癌的枷锁
结直肠癌是全球第三大常见癌症,也是第二常见致死癌症。对于一线治疗后进展的转移性结直肠癌患者而言,后续可选的治疗方法有限,患者备受疾病折磨,预后极差。
在2020年ASCO会议上公布的DESTINY-CRC01是一项针对既定既往接受过两线及以上标准治疗的HER2阳性,不可切除和/或转移性结直肠癌患者开展的II期临床试验的方法。
此试验结果表明,经DS-8201单药治疗后,患者的肿瘤客观缓解率为45.3%,其中完全缓解率为1.9%,部分缓解率为43.4%,疾病控制率(DCR)达83.0%,患者的中位无进展生存期(PFS)为6.9个月。
03、客观缓解率达61.9%,DS-8201引领肺癌靶向治疗掀起创新革命
今年ASCO大会上发布的DESTINY-Lung01研究是针对既往往接受过一种或多种系统治疗,出现疾病进展的HER2突变型(HER2m)不可切除和/或转移性非鳞非小细胞肺癌(NSCLC)患者展开的,其中大多数患者曾接受过含铂化疗(90.5%)和抗PD-1或PD-L1治疗(54.8%)等治疗。
研究结果表明,接受DS-8201单药治疗(6.4mg / kg)的,61.9%的患者获得肿瘤缓解,疾病控制率(90.5%)和中位无进展生存期(14.0个月)得到显着改善。
近期,DS-8201被美国FDA批准用于治疗HER2突变转移性非小细胞肺癌的突破性疾病疗法,进一步证明了HER2突变是临床治疗的靶标,成为HER2突变NSCLC 患者新的希望。
04、有效率51%!DS-8201成为晚期胃癌治疗药物的一匹黑马
在DESTINY-Gastric01的临床研究中,评估了DS-8201在HER2阳性晚期胃或胃食管交界处(GEJ)腺癌患者中的有效性。
纳入187例接受过至少两次治疗的HER2阳性胃或胃食管交界处腺癌患者,所有患者随机分组,分别接受DS-8201(125例)或化疗(62例),其中日本患者占79.7%,韩国患者占20.3%。
研究结果显示:
客观缓解率(ORR):DS-8201组的为51.3%(61/119),包括11例完全缓解(CR)和50例部分缓解(PR),而化疗方案组仅为14.3%(8/56);
疾病控制率(DCR):分别为85.7%和62.5%(P=0.0005);
中位缓解持续时间(DoR):分别为11.3个月和3.9个月。
中位总生存期(OS):分别为12.5个月和8.4个月。
中位无进展生存期(PFS):分别为5.6个月和3.5个月。
在HER2、晚期胃或胃食管交界癌患者中,DS-8201的客观缓解率明显高于常规化疗,总生存期较常规化疗更长,与化疗方案相比其死亡风险降低41%(HR=0.59)。
鉴于此,美国FDA授予Enhertu突破性疗法认定,用于治疗HER2阳性的不可切除或转移性胃癌患者;并授予孤儿药资格,用于治疗包括胃食管交界处癌体内的胃癌患者。
无癌家园专家建议
在ASCO会议上,DS-8201在胃癌、前列腺癌、结直肠癌等治疗方面均展现出绝对实力,将有望成为HER2阳性癌症患者新的标准疗法。目前,针对HER2驱动的乳腺癌、胃癌、结直肠癌、肺癌等多个癌种的临床试验正在进行中。
然而在这里需要提醒大家的是,如何检测HER2是精准治疗癌症的关键!
因此,各位癌友们一定要慎重选择检测机构,如做过检测的病友可以联系无癌家园(400-626-9916)进行解读,评估可用的治疗方案。
T-DM1获批,成为中国首个ADC类靶向抗癌药
2020年1月22日,罗氏制药中国宣布,国家药品监督管理局正式批准创新靶向药物赫赛莱(即大家熟知的T-DM1,商品名:Kadcyla,通用名:恩美曲妥珠单抗)上市,其地位非同一般,不仅是全球首个获批的单药治疗实体瘤的抗体药物偶联物(ADC),更是中国第一个HER2靶向ADC产品。此药适用于接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗。
赫赛莱之所以能够快速在中国获批,正是由于其在KATHERINE 3期临床试验中的效果显著。此项研究中,赫赛莱组患者辅助治疗3年内,无侵袭性癌生存率达到88.3%,曲妥珠单抗组为77%。此外研究也证实在使用T-DM1以后,无论雌激素受体(ER)阳性还是阴性,是否可手术,甚至肿瘤残留很小的患者、小于1cm或者淋巴结阴性的患者,风险比HR为0.6 ,意味着对于新辅助治疗手术后仍有残存病灶的HER2阳性乳腺癌患者,在使用恩美曲妥珠单抗治疗后,能够进一步降低50%的疾病复发及死亡风险。
在转移性乳腺癌方面,在经曲妥珠单抗或紫杉烷类单药或两者联合治疗后仍有进展的Her2阳性转移性乳腺癌患者中(EMILIA试验),“Kadcyla单药治疗组”与“拉帕替尼+卡培他滨组”相比,Kadcyla单药:
可使患者的中位总生存期从25.1个月延长到30.9个月,延长近乎半年的时间。
中位无进展生存期由原来的6.4个月延长到9.6个月,整整提高了50%。
死亡风险降低59%,首款靶向TROP-2的ADC药物IMMU-132来袭
在2020年4月22日,美国FDA已加速批准其抗体偶联药物Trodelvy(sacituzumab govitecan-hziy)上市,用于治疗既往接受过至少2种疗法的转移性三阴乳腺癌(mTNBC)成人患者,批准时间比预定的6月2日审批日期提前了一个半月!
这意味着,Trodelvy是FDA批准的首个治疗三阴乳腺癌的抗体偶联药物,也是全球首个获批的靶向人滋养层细胞表面抗原2(Trop-2)的抗体偶联药物。
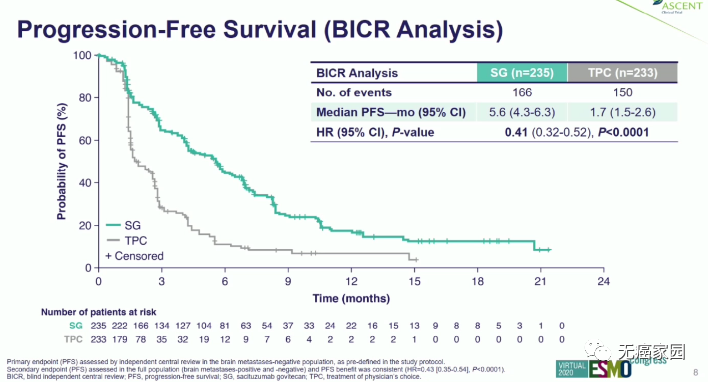
2020年ESMO大会公布了IMMU-132 ASCENT三期试验数据:与先前选择单药化疗的转移性三阴性乳腺癌(TNBC)患者相比,选择sacituzumab govitecan(Trodelvy)治疗可将疾病进展或死亡的风险降低59%。
结果显示:
中位无进展生存期(PFS)
sacituzumab govitecan组为5.6个月,标准治疗组为1.7个月;
中位总生存期(OS)
sacituzumab govitecan组12.1个月,标准治疗组为6.7个月,也几乎翻了一倍。
Padcev为PD-1/PD-L1抗体无效患者另辟蹊径
2019年12月18日,FDA加速批准Padcev(EnfortumabVedotin,简称EV)上市,成为近年来第二个用于实体瘤治疗的ADC药物。Padcev最大的亮点是可用于PD-1/PD-L1抗体无效的患者。
在此之前关于EV-201临床试验的第一批研究结果显示,患者完全缓解率为12%,部分缓解率为32%,疾病稳定率为34%,客观缓解率可达44%,因此得到了美国FDA加速批准上市的优待。
而就在2020年10月12日公布了II期EV-201研究第二批患者的疗效数据。结果显示,接受PADCEV治疗的患者,整体缓解率52%,中位缓解持续时间10.9个月。
研究证实,PADCEV治疗曾接受过PD-1/PD-L1药物治疗且未接受包括顺铂在内的含铂化疗的患者,取得了阳性的结果,疗效显著。
我国自主研发!泛癌种的化疗新药莱古比星横空出世
说到“化疗药”,不得不谈到我国自主研发的泛癌种化疗新药莱古比星。这款药物与多柔比星相比,对于正常细胞的伤害更小,造成的心脏毒性、过敏性、溶血性及血管与肌肉刺激性更小,安全性更高,且针对多种实体瘤均有显著疗效,有望使更多患者受益。
而在针对脑星星胶质母细胞瘤小鼠模型的研究中,采用莱古比星治疗,在有效药物等含量的情况下,莱古比星的疗效比多柔比星更强。
此外,在小鼠模型中的研究结果显示,多柔比星+PD-1治疗的完全缓解率为12.5%,莱古比星+PD-1达到了87.5%。
也就是说,莱古比星联合治疗方案的完全缓解率达到了多柔比星的7倍!
目前,莱古比星已经被认定为化学1类新药,并获得了国家药品监督管理局的临床试验批准(2018L02645),允许进行临床试验。就在近期,莱古比星的Ⅰ期临床试验开始招募患者了!若有意向参与临床试验,可以联系无癌家园(400-626-9916)。
小编有话说
随着全球ADC药物获批数量的增多,小编相信将会有越来越多的癌友们获益,若想了解更新的临床试验或国际会诊请咨询无癌家园医学部。我们坚信在不久的将来,随着中国政策的不断完善,ADC药物在中国的可及性也会明显增高,这些药物的到来,将会为癌友们,尤其是晚期恶性肿瘤患者带来新的选择。


































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城