2025"医药界诺奖"抗癌榜单揭晓:国产CART细胞疗法领衔横扫十大癌种,从5年无复发到生存期翻倍
盖伦奖(Prix Galien Award)由法国药物学家Roland Mehl于1969年创立,是生物医药与医疗技术领域重要奖项,被誉为“医药界的诺贝尔奖”,其抗癌类提名更是全球肿瘤药物创新的风向标。该奖项入围门槛明确:药品或生物技术需近5年内获美国药监局(FDA)批准上市,且能显著改善人类健康。
盖伦奖入围名单既是当下肿瘤治疗技术的“成绩单”,也是未来癌症治疗革命的“路线图”——正通过技术融合(如ADC+放疗)、资源整合(资本与研发协同)、临床范式迭代(精准治疗与联合方案),重塑从实验室到病床的全链条医疗生态。随着基因疗法、纳米机器人等颠覆性技术的介入,未来癌症治疗有望从“延长生命”迈向“功能性治愈”。
2025年美国盖伦奖(Prix Galien USA)已于8月11日公布最终入围名单,一批疗效卓越、能改善患者预后的抗癌“新武器”上榜。小编更新了上榜名单,不妨看看今年有哪些重磅抗癌新药/新技术上榜,以供癌友们参考。
2025年盖伦奖抗癌领域入围名单盘点,涵盖肺癌、胰腺癌、卵巢癌、脑瘤等十大癌种
抗癌入围名单速览
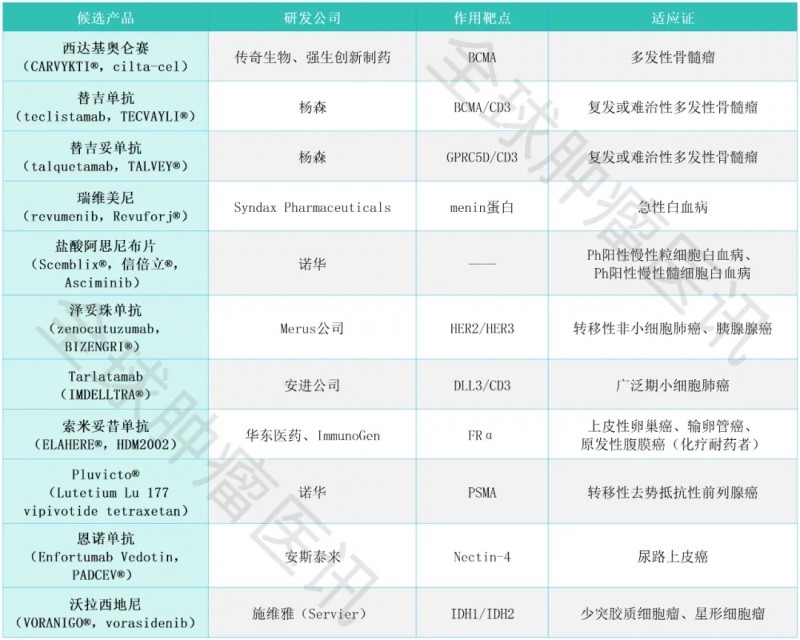
01、西达基奥仑赛(CARVYKTI®)
药物简介
①药物名称:西达基奥仑赛(CARVYKTI®,cilta-cel)。
②作用靶点:BCMA。
③适应证:复发或难治性多发性骨髓瘤。
④研发公司:传奇生物、强生创新制药。
⑤获批时间:2024年8月27日(中国)、2024年4月5日(美国)。
药物详情
西达基奥仑赛是一款靶向BCMA的CAR-T细胞疗法,具有多重里程碑意义:它是首款获美国FDA批准的国产CAR-T疗法,也是我国获批的第6款CAR-T产品,更是目前全球唯一获批用于多发性骨髓瘤二线治疗的BCMA靶向疗法。
2024年4月5日,获美国FDA批准,用于治疗成人复发或难治性多发性骨髓瘤(R/RMM);同年8月27日,中国国家药品监督管理局(NMPA)也批准了西达基奥仑赛,用于既往接受过1种免疫调节剂和1种蛋白酶抑制剂治疗的复发或难治性多发性骨髓瘤的治疗。
关键疗效摘要
根据3期CARTITUDE-4临床研究(NCT04181827)数据,西达基奥仑赛(CARVYKTI®)疗效显著:与标准治疗组相比,其治疗组患者总体缓解率更高(84.6%vs.67.3%),12个月无进展生存率也更优(75.9%,95%CI:69.4-81.1;标准治疗组为48.6%,95%CI:41.5-55.3)。此外,该疗法可使多发性骨髓瘤患者死亡风险降低45%,且患者单次输注后,单次输注后5年无复发率约为33%,这也意味着约三分之一患者在五年内无复发。
02、替吉单抗(TECVAYLI®)
药物简介
①药物名称:替吉单抗(teclistamab,TECVAYLI®)。
②作用靶点:BCMA/CD3。
③适应证:复发或难治性多发性骨髓瘤。
④研发公司:杨森。
⑤获批时间:2022年10月25日。
药物详情
替吉单抗(teclistamab,TECVAYLI®)是强生旗下杨森公司研发的一款BCMA/CD3双特异性抗体药物,2022年10月25日,获美国FDA批准,用于治疗成人复发或难治性多发性骨髓瘤,这些患者曾经接受过四种及以上治疗手段,包括蛋白酶体抑制剂、免疫调节药物和抗CD38单克隆抗体,并且疾病仍然出现进展。。
关键疗效摘要
替吉单抗本次获批主要基于一项关键的2期MajesTEC-1临床试验数据,结果显示:总缓解率(ORR)达到63%,且58.8%的患者获得很好的部分缓解或更好缓解(≥VGPR),39.4%的患者获得完全缓解(CR)以上的应答;中位缓解持续缓解时间(MDOR)为18.4个月,中位无进展生存期(mPFS)为11.3个月,中位总生存期为18.3个月。
03、替吉妥单抗(TALVEY®)
药物简介
①药物名称:替吉妥单抗(talquetamab,TALVEY®)。
②作用靶点:GPRC5D/CD3。
③适应证:复发或难治性多发性骨髓瘤。
④研发公司:杨森公司。
⑤获批时间:2023年8月。
药物详情
替吉妥单抗(talquetamab,TALVEY®)是一种人源化免疫球蛋白G4(IgG4)双特异性抗体,通过与T细胞上的CD3和表达GPRC5D的细胞结合,阻止肿瘤生长并使已建立的肿瘤消退。
2023年8月,获美国FDA加速批准,用于复发或难治性多发性骨髓瘤成人患者的治疗,这些患者既往接受过至少4种疗法,包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体。
关键疗效摘要
该药获FDA批准,主要基于MonumenTAL-1研究的数据支持。结果显示:在接受每周治疗的患者中(n=100),总体应答率(ORR)达73%(95%CI,63.2-81.4)。
04、瑞维美尼(Revuforj®)
药物简介
①药物名称:瑞维美尼(revumenib,Revuforj®)。
②作用靶点:menin蛋白。
③适应证:急性白血病。
④研发公司:Syndax Pharmaceuticals。
⑤获批时间:2024年11月15日。
药物详情
瑞维美尼是一款Menin抑制剂,2024年11月15日获美国FDA批准,用于成人和1岁以上儿童患者KMT2A(赖氨酸甲基转移酶2A基因)易位的复发或难治性急性白血病的治疗。2025 年,FDA 又授予其补充新药申请(sNDA)优先审查资格,用于治疗复发或难治性 NPM1 突变急性髓系白血病,若能顺利获批,其适应症将进一步扩展。
关键疗效摘要
瑞维美尼本次获批主要基于一项AUGMENT-101临床试验(NCT04065399)的疗效评估,CR(完全缓解)+CRh(CR伴部分血液学恢复)率为21.2%,中位 CR+CRh持续时间为6.4个月。
05、盐酸阿思尼布片(Scemblix®)
药物简介
①药物名称:盐酸阿思尼布片(Asciminib,Scemblix®,信倍立®)。
②适应证:Ph阳性慢性粒细胞白血病、Ph阳性慢性髓细胞白血病。
③研发公司:诺华。
④获批时间:2024年10月29日(美国)、2025年5月14日(中国)。
药物详情
阿思尼布(asciminib)是一种针对慢性髓细胞白血病(CML)的靶向治疗药物,2024年10月29日,获FDA批准,用于成人新诊断的费城染色体阳性慢性粒细胞白血病(Ph+CML)慢性期的治疗。2025年5月14日,该药在中国获批,用于成人新诊断的费城染色体阳性的慢性髓细胞白血病(Ph+CML)慢性期(CP)的治疗。
近日,更是传来好消息,根据国家医保局发布的《2025年国家基本医疗保险、生育保险和工伤保险药品目录及商业健康保险创新药品目录调整工作方案》,阿思尼布有望进入2025新版医保目录。
关键疗效摘要
一项ASC4FIRST临床试验(NCT04971226)结果显示:阿思尼布的MMR(主要分子反应)率明显优于标准治疗,48周时的MMR率分别为68%(阿思尼布组) vs 49%[酪氨酸激酶抑制剂(IS-TKI组)]。
06、泽妥珠单抗(BIZENGRI®)
药物简介
①药物名称:泽妥珠单抗(zenocutuzumab,BIZENGRI®)。
②作用靶点:HER2/HER3。
③适应证:转移性非小细胞肺癌、胰腺腺癌。
④研发公司:Merus。
⑤获批时间:2024年12月4日。
药物详情
泽妥珠单抗(zenocutuzumab,BIZENGRI®)是由Merus公司开发的一款HER2/HER3双特异性抗体药物,可针对NRG1融合发挥治疗作用。
2024年12月4日,获美国FDA加速批准上市,用于治疗携带神经调节蛋白1(NRG1)基因融合的晚期、不可切除或转移性非小细胞肺癌(NSCLC)或胰腺腺癌成人患者,这些患者的癌症在之前的治疗中已经进展。它是FDA批准的首个也是唯一一个专门针对这一患者群体的治疗药物。
关键疗效摘要
该药获批主要基于一项eNRGy研究的数据,结果显示,非小细胞肺癌的总体缓解率为33%,胰腺癌的总体缓解率为40%,缓解持续时间为3.7~16.6个月。
07、Tarlatamab(IMDELLTRA®)
药物简介
①药物名称:Tarlatamab(IMDELLTRA®)。
②作用靶点:DLL3/CD3。
③适应证:广泛期小细胞肺癌。
④研发公司:安进公司。
⑤获批时间:2024年5月16日。
药物详情
Tarlatamab是一种双特异性T细胞接合剂(BiTE)的免疫治疗方法,可与癌细胞上的DLL3(δ样配体3)、CD3结合,并将患者的T细胞,引导至表达DLL3的癌细胞,从而帮助T细胞识别并摧毁癌细胞。该药是目前首个也是唯一一款获批用于治疗侵袭性肺癌的DLL3靶向双特异性T细胞接合疗法。
其中,DLL3是一种抑制Notch信号传导的蛋白质,通常情况下位于正常细胞的内部,但在85%~94%的小细胞肺癌(SCLC)的细胞表面异常表达,使其成为治疗小细胞肺癌的潜在靶点。
2024年5月16日,Tarlatamab(IMDELLTRA®)获美国FDA批准,用于治疗在铂类化疗期间或之后疾病进展的广泛期小细胞肺癌(ES-SCLC)成年患者。
关键疗效摘要
Tarlatamab本次获批基于2期DeLLphi-301临床试验结果,其疗效显著优于传统疗法:既往接受标准治疗复发的小细胞肺癌患者,客观缓解率(ORR)仅为15%;而Tarlatamab治疗组中,100mg组ORR达32%,10mg组ORR更高至40%,较传统疗法提升超一倍。生存数据方面,10mg组患者中位无进展生存期(PFS)为4.9个月,100mg组为3.9个月;治疗9个月时,两组患者总生存率估计值分别为68%(10mg组)和66%(100mg组)。
08、索米妥昔单抗(ELAHERE®)
药物简介
①药物名称:索米妥昔单抗(ELAHERE®,HDM2002)。
②作用靶点:FRα(叶酸受体α分子)。
③适应证:上皮性卵巢癌、输卵管癌或原发性腹膜癌(化疗耐药者)。
④研发公司:华东医药、ImmunoGen。
⑤获批时间:2024年3月22日。
药物详情
索米妥昔单抗是全球首创的靶向叶酸受体α(FRα)阳性卵巢癌的抗体偶联药物(ADC),堪称“智能抗癌导弹”。由于叶酸受体α在76%-89%的上皮卵巢癌中高表达,该药具备明确的攻击靶点。其作用机制精准高效:药物进入肿瘤细胞后,连接子在特定条件下裂解,释放出强效细胞毒性药物美登木素生物碱DM4——如同释放“炸弹”,从细胞内部破坏肿瘤细胞,干扰其正常微管功能,进而诱导肿瘤细胞凋亡。相较于传统化疗,这种方式大幅提升了对肿瘤细胞的杀伤效果,同时减少了对正常细胞的损害。
2024年3月22日,获美国FDA全面批准,用于成人叶酸受体α(FRα)阳性、铂耐药的卵巢上皮、输卵管或原发性腹膜癌的治疗。
该药也是首个且目前唯一获美国FDA批准的用于治疗此类恶性肿瘤的ADC药物,标志着铂耐药的复发性卵巢癌至此进入ADC治疗新时代!
关键疗效摘要
2025年欧洲肿瘤内科学会(ESMO)妇科肿瘤年会上,II期PICCOLO试验(NCT05041257)数据公布,结果显示索米妥昔单抗对FRα阳性的复发性铂敏感卵巢癌(PSOC)患者疗效显著:研究者评估的确认客观缓解率(ORR)达51.9%(95%CI:40.4%-63.3%),其中完全缓解(CR)率7.6%、部分缓解(PR)率44.3%;在中位随访26.6个月时,患者中位总生存期(OS)为27.17个月(95%CI:23.79-未达到)。
09、PLUVICTO®
药物简介
①药物名称:Pluvicto®(Lutetium Lu 177 vipivotide tetraxetan)。
②作用靶点:PSMA。
③适应证:转移性去势抵抗性前列腺癌。
④研发公司:诺华。
⑤获批时间:2022年3月23日。
药物详情
Pluvicto®(Lutetium Lu 177 vipivotide tetraxetan)是首款获美国FDA批准用于治疗转移性去势抵抗性前列腺癌(mCRPC)患者的靶向放射配体疗法。
作为具有“自动追踪性”的放射性配体疗法药物,其分子中的靶向配体可与前列腺特异性膜抗原(PSMA)阳性的前列腺癌细胞结合——PSMA在超过80%的前列腺癌患者体内可检测到;结合后,药物会将放射性同位素镥-177携带至肿瘤细胞处,释放能量破坏靶细胞,抑制其复制能力并引发肿瘤细胞死亡。
该药于2022年3月23日获FDA批准上市,适应症为PSMA阳性、转移性去势抵抗性前列腺癌(mCRPC)患者。
关键疗效摘要
3期PSMAfore临床研究显示,与传统治疗相比,PLUVICTO®能显著延长患者肿瘤控制时间:在Pluvicto治疗组中,半数患者至少可维持9.3个月肿瘤不进展,显著优于对照组(标准治疗)的5.6个月。
10、恩诺单抗(PADCEV®)
药物简介
①药物名称:恩诺单抗(Enfortumab Vedotin,PADCEV®)。
②作用靶点:Nectin-4。
③适应证:尿路上皮癌。
④研发公司:安斯泰来。
⑤获批时间:2019年12月。
药物详情
恩诺单抗是一款靶向Nectin-4的ADC药物,2019年12月,或美国FDA加上批准,用于治疗局部晚期或转移性尿路上皮癌,并于2022年获得欧盟范围内的营销批准。它是首个获批治疗尿路上皮癌的ADC药物,同时也是首个获批以Nectin-4为靶点的药物。
关键疗效摘要
恩诺单抗1期EV-101临床研究数据显示,客观缓解率(ORR)达到43%,中位总生存期(OS)长达12.3个月,1年OS率达到51.8%。
11、沃拉西地尼(VORANIGO®)
药物简介
①药物名称:沃拉西地尼(VORANIGO®,vorasidenib)。
②作用靶点:IDH1/IDH2。
③适应证:少突胶质细胞瘤、星形细胞瘤。
④研发公司:施维雅(Servier)。
⑤获批时间:2024年8月6日。
药物详情
沃拉西地尼(vorasidenib,VORANIGO®)是由施维雅(Servier)公司研发的一款口服IDH1和IDH2双重抑制剂,是首个也是唯一一个获得FDA批准的针对2级IDH突变型胶质瘤的靶向治疗药物。
2024年8月6日,该药获美国FDA批准上市,用于12岁及以上伴有易感IDH1或IDH2突变的2级少突胶质细胞瘤或星形细胞瘤儿童和成人患者,这些患者此前接受过包括活检、次全切或全切在内的手术。
关键疗效摘要
关键性3期INDIGO临床试验数据显示:VORANIGO®组和安慰剂组患者的中位无进展生存期(PFS)分别为27.7个月和11.1个月,同时该药将患者疾病进展或死亡风险降低61%。
小编寄语
从2025年盖伦奖入围名单可见,癌症治疗正迎来真正的“武器升级”:已从传统放化疗,迈向免疫、靶向、双抗、ADC等多疗法协同发力的新阶段。无论是“一次治疗、五年无复发”的新型CAR-T疗法,还是为罕见基因融合癌量身定制的靶向药,亦或是让晚期患者生存期翻倍的免疫组合疗法,都在不断重新定义癌症治疗的“生死线”。此外,还有多款抗癌新药与新技术正处于火热研发中。
不过需要提醒广大癌友,癌症具有高度突变、极具侵袭性的特点,目前仅靠单一疗法难以达到理想治疗效果。现阶段理想的抗癌方案,需以权威医院与专家的早期规范诊断为基础,在手术、放化疗等传统治疗前提下,结合患者自身状况、疾病特征、经济条件等,灵活联用CAR-T、TCR-T、TIL、NK、CAR-NK等免疫细胞疗法,以及癌症疫苗、靶向药物、硼中子俘获疗法、质子治疗等新药与新技术,从而有效预防癌症复发转移,尽可能延长患者生存期、提升生存质量。
对现阶段治疗方案不满意的患者,可将近期影像及病理检查报告、治疗经历等,提交至医学部,详细评估病情,或申请国内外抗癌专家会诊,寻求抗癌新药/新技术的帮助。
参考资料
[1]Ahn M J,et al.Tarlatamab for patients with previously treated small-cell lung cancer[J]. New England Journal of Medicine, 2023, 389(22): 2063-2075.
https://www.nejm.org/doi/full/10.1056/NEJMoa2307980


































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城