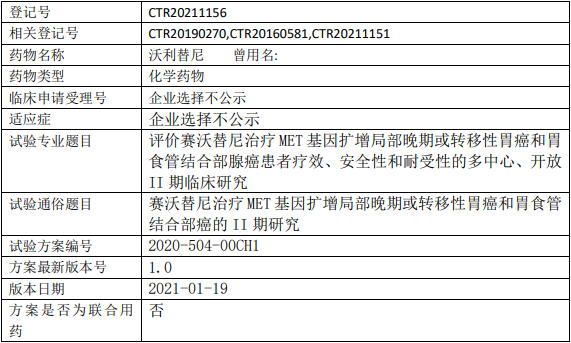
和记黄埔赛沃替尼临床试验,赛沃替尼(曾用名沃利替尼)治疗MET基因扩增局部晚期或转移性胃癌和胃食管结合部癌的II期研究
1、试验目的
1)评价赛沃替尼治疗 MET 基因扩增的局部晚期或转移性胃癌及胃食管结合部腺癌患者的临床疗效
2)评价赛沃替尼治疗 MET 基因扩增的局部晚期或转移性胃癌及胃食管结合部腺癌患者的安全性和耐受性
3)评价赛沃替尼连续给药在MET 基因扩增的局部晚期或转移性胃癌及胃食管结合部腺癌患者中的稳态药代动力学(PK)特征
4)探索赛沃替尼对患者 MET 及其他生物标志物的影响
5)评价赛沃替尼对患者生活质量评分的影响
2、试验设计
试验分类:安全性和有效性
试验分期:II 期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
入选标准
1.对本研究已充分了解并自愿签署知情同意书,愿意并能够遵从研究流程;
2.年龄≥18 岁
3.经病理组织学或细胞学诊断的局部晚期或转移性胃癌或胃食道结合部腺癌;
4.MET 基因扩增;
5.既往至少一线系统性抗肿瘤药物治疗后疾病进展;
6.队列 1:至少有一个根据 RECIST 1.1 标准的可测量的胃部以外的病灶;局限于胃或胃食管结合部的局部肿块归类为不可测量病灶;队列 2:没有根据 RECIST 1.1 标准的可测量的胃部以外的病灶,但有可评估病灶;
7.ECOG 体力状况评分 0~2 分;(队列 2 中对于因肺转移癌性淋巴管炎导致缺氧而身体状况差的患者,ECOG 评分高于 2 分也可入组);。
8.预期生存超过 12 周;
9.具有足够的骨髓、肝肾器官功能
10.无凝血功能异常
11.能口服和吞咽药物。
12.有生育能力的女性患者必须同意在筛选期至研究药物停用 4 周内使用有效的避孕方法,性伴侣为育龄期女性的男性患者在研究期间和研究药物停用 6 个月之内,性交时须使用避孕套;
排除标准
1.1.现在罹患其它恶性肿瘤,或过去 5 年内患其它浸润性恶性肿瘤。患有 I 期恶性肿瘤经过根治至少 3 年,研究者认为复发可能性小的除外。患有经根治过的原位癌(非浸润性)及除恶性黑素瘤以外的皮肤癌患者可以入选;
2. 研究治疗开始前 3 周内进行过抗肿瘤治疗,包括化疗,激素治疗,生物治疗、免疫治疗或抗肿瘤适应症的中药,或者研究治疗开始前 2 周内接受过小分子酪氨酸激酶抑制剂;
3. 研究治疗开始前 4 周内接受广泛放射治疗(包括放射性核素治疗如锶-89)或研究治疗开始前 1 周内接受过姑息性局部放疗或上述放疗不良反应未恢复;
4. 首次用药前 60 天内接受近距离放射疗法(放射粒子植入);
5. 研究治疗开始前 4 周内接受过大手术或研究治疗开始前 1 周内接受过小手术(静脉置管术、穿刺引流等除外);
6. 研究治疗开始前 2 周内(贯叶连翘为 3 周)服用过 CYP3A4 的强诱导剂,或 CYP1A2 的强抑制剂;
7. 既往抗癌治疗的毒性反应尚未恢复到 0 或者 1 级水平(脱发和奥沙利铂引起的外周神经毒性除外);
8. 具有临床意义的感染性疾病;9. 有显著临床意义的心血管疾病,包括但不限于:研究治疗开始前 6 个月内有急性心肌梗死、不稳定心绞痛,中风或短暂性缺血性发作、或美国纽约心脏病学会(NYHA)分级为 2 级以上(含2级)的充血性心力衰竭;任何重要的心律失常;平均静息校正QT间期延长(女性>470msec,男性>450msec);
10. 药物不能控制的高血压(即药物治疗后血压≥150/95 mmHg);
11. 研究治疗开始前存在脑膜转移,脊髓压迫,或活动性脑转移;但无症状(如无神经功能障碍,癫痫或其它典型中枢神经系统转移症状和体征)且不需要皮质类固醇激素或抗癫痫治疗的脑转移患者可入选;接受脑部放疗患者,有影像学证据显示脑转移病灶距首次影像学诊断脑转移无进展至少 4 周的可入选;
12. 已知存在癌性血栓或深静脉血栓,但低分子肝素(LMWH)或类似功效药物治疗稳定<2 周者可入组
13. 活动性胃肠道疾病或其它情况显著影响口服研究药物的吸收,分布,代谢或排泄(如活动性溃疡、难治性恶心、呕吐、2 级或以上腹泻和吸收不良综合征);
14. 妊娠或哺乳期妇女
15. 研究治疗开始前 3 周内参加过其它药物临床试验且服用过研究药物;
16. 已知对赛沃替尼活性或非活性成分过敏者;
17. 曾经接受过或正在接受任何针对 MET 的治疗(例如,但不限于克唑替尼、tepotinib、capmatinib);
18. 任何其它疾病,代谢异常,体格检查异常或实验室检查异常,根据研究者判断,有理由怀疑患者具有不适合使用研究药物的某种疾病或状态,或者将会影响研究结果的解读,或者使患者处于高风险的情况。
研究者信息
1、主要研究者信息
姓名:沈琳
学位:医学博士
职称:主任医师
单位名称:北京大学肿瘤医院
2、各参加机构信息
| 序号 | 机构名称 | (主要)研究者 | 国家 | 省(州)-城市 |
| 1 | 北京大学肿瘤医院 | 沈琳 | 中国 | 北京市-北京市 |
| 2 | 中国医学科学院北京协和医院 | 白春梅 | 中国 | 北京市-北京市 |
| 3 | 浙江医科大学第二附属医院 | 袁瑛 | 中国 | 浙江省-杭州市 |
| 4 | 浙江大学医学院附属邵逸夫医院 | 潘宏铭 | 中国 | 浙江省-杭州市 |
| 5 | 安徽省立医院 | 潘跃银 | 中国 | 安徽省-合肥市 |
| 6 | 北京大学深圳医院 | 王树滨 | 中国 | 广东省-深圳市 |
| 7 | 武汉协和医院 | 刘红利 | 中国 | 湖北省-武汉市 |
| 8 | 郑州大学第一附属医院 | 秦艳茹 | 中国 | 河南省-郑州市 |
| 9 | 河南省肿瘤医院 | 王居峰 | 中国 | 河南省-郑州市 |
| 10 | 中国医科大学附属第一医院 | 曲秀娟 | 中国 | 辽宁省-沈阳市 |
| 11 | 吉林大学第一医院 | 李薇 | 中国 | 吉林省-长春市 |
| 12 | 哈尔滨医科大学附属肿瘤医院 | 白玉贤 | 中国 | 黑龙江省-哈尔滨市 |



























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城