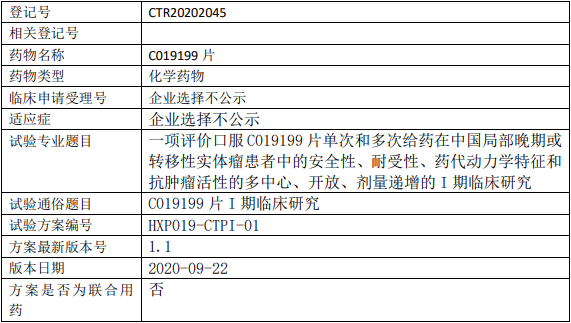
C019199临床试验,C019199片治疗局部晚期或转移性实体瘤的I期临床试验
1、试验目的
主要目的:确定 C019199 片在局部晚期或转移性实体瘤患者中口服的最大耐受剂量(MTD)、II 期试验推荐剂量(RP2D)、剂量限制性毒性(DLT)和安全性。
次要目的:考察 C019199 片在局部晚期或转移性实体瘤患者中单、多次口服给药的药代动力学(PK)特征;初步观察 C019199 片在局部晚期或转移性实体瘤患者中的抗肿瘤活性。
探索性目的:探索用于预测 C019199 片抗肿瘤活性的潜在生物标志物。
2、试验设计
试验分类:其他其他说明:安全性和有效性、药代动力学/药效动力学试验
试验分期:I 期
设计类型:平行分组
随机化:非随机化
盲法:开放
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至 76 岁(最大年龄)
性别:男+女
健康受试者:无
入选标准
1.签署知情同意书时,年龄≥18 周岁且<76 周岁,男女不限。
2.经组织学和/或细胞学确诊的局部晚期或转移性实体瘤,包括TGCT 患者;局部晚期或转移性实体瘤患者。
剂量递增阶段:按照NCCN 指南定义的标准治疗失败、目前无标准治疗或患者无法接受标准治疗的复发、转移的晚期实体瘤患者。
剂量扩展阶段:按照NCCN 指南定义的标准治疗失败、目前无标准治疗或患者无法接受标准治疗的软组织肉瘤患者、复发、转移的晚期结直肠癌患者、黑色素瘤患者、胰腺癌患者。
TGCT 患者,满足以下标准:
1) 手术切除可能导致功能受限或严重并发症(局部晚期);
2) 首次给药前 2 周内,镇痛治疗方案已稳定。
3.ECOG 评分 0~1 分。
4.预计生存期≥3 个月。
5.至少有一个可测量或可评估的肿瘤病灶(RECIST v1.1),仅限扩展试验。
6.按下述实验室检查结果定义,无严重的造血功能异常,心、肺、肝、肾功能基本正常,这些检查结果需在首次给药前 7 天内完成:
a) 骨髓储备: 血红蛋白≥10g/dL 、中性粒细胞≥1500/mm3 且血小板≥100000/mm3;
b) 凝血功能:国际标准化比值(INR)与活化部分凝血活酶时间(APTT)均≤1.5×ULN(正常值上限);
c)肾功能:肌酐≤1.5×ULN;
d) 肝功能:胆红素≤1.5×ULN、丙氨酸转氨酶(ALT)≤2.5×ULN且天冬氨酸转氨酶(AST)≤2.5×ULN(对于有肝脏转移者,胆红素≤3×ULN、ALT≤5×ULN且AST≤5×ULN)。
e) 心脏功能:纽约心脏病协会心功能 II 级或以下、左心室射血分数(LVEF)>50%;
7.男性或女性患者同意在研究治疗期间和末次给药后6 个月内采用医学认可的避孕措施进行有效避孕或禁欲。
8.理解并自愿签署书面知情同意书(ICF),有意愿和能力完成定期访视、治疗计划、实验室检查及其他试验过程。
排除标准
1.既往接受过 CSF1R 抑制剂治疗者。
2. 已知对 CSF1R 抑制剂类药物过敏者。
3. 首次给药前 4 周内至治疗结束期间需进行(或进行过)放疗(用于控制症状的姑息性放疗除外)、化疗、靶向治疗、内分泌治疗等抗肿瘤治疗,或其他临床试验药物治疗。其中丝裂霉素和亚硝基脲类为首次给药前 6 周内,CYP3A 强抑制剂/诱导剂、治疗指数较窄的 CYP3A 敏感底物以及氟尿嘧啶类的口服药物如替吉奥、卡培他滨为首次给药前 2 周内。
4. 首次给药前 4 周(或 5 个单抗药物半衰期,取时间长者)内至治疗结束期间需进行(或进行过)免疫检查点抑制剂或免疫调节单抗类药物治疗(抗肿瘤或非抗肿瘤)。
5. 尚未从既往治疗毒性中恢复的(即筛选时毒性为 2 级及以上,脱发除外)。6. 首次给药前 4 周内进行过大型手术(三或四级)且未完全恢复。
7. 因既往手术史或严重的胃肠道疾病如吞咽困难、活动性胃溃疡、溃疡性结肠炎、克隆氏病、肠梗阻等,研究者认为可能影响研究药物的吸收、分布、代谢等。
8. 任何显著的临床和实验室异常,研究者认为有临床意义者,如:无法控制的活动性感染(CTCAE v5.0 2 级)、无法控制的糖尿病(指最佳药物治疗情况下,空腹血糖>7mmol/L)、无法控制的高血压(指最佳药物治疗情况下,收缩压> 140mmHg 和/或舒张压>90mmHg)、2 级或以上周围神经病变(CTCAE v5.0)、2 级或以上充血性心力衰竭(CTCAE v5.0)、6 个月内的心肌梗塞、慢性肾病、甲状腺功能异常、酒精性肝炎或者其他肝炎、严重肝硬化、脂肪肝、遗传性肝脏疾病、肝萎缩、门静脉高压、无法控制的重大癫痫发作或上腔静脉综合征。
9. 患有本研究所治疗肿瘤以外的其他恶性肿瘤疾病(例外情况包括:治愈且在研究入选前 3 年内没有复发的恶性肿瘤;完全切除的基底细胞和鳞状细胞皮肤癌;完全切除的任何类型的原位癌)。
10. 筛选期进行影像学评估,经计算机断层扫描(CT)或核磁共振成像(MRI)检测发现活动性或未治疗的中枢神经系统(CNS)转移灶:
a) 如果在筛选期扫描时检测到受试者出现新的无症状 CNS转移,则必须接受放射治疗和/或 CNS 转移灶的手术。上述治疗结束后,如果满足全部其他标准,无需进行入选前额外的脑部扫描;
b) 既往接受过脑或脑膜转移治疗,如临床稳定已维持至少 2 个月,并且已经停止全身性激素治疗(剂量>10mg/天的泼尼松或其它等疗效激素)大于 4 周的受试者可以纳入。
11. 已知人类免疫缺陷病毒(HIV)、乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)中至少一项活动性感染者。以下情况可入选本研究:
a) 人类免疫缺陷病毒抗体(HIV-Ab)阴性;
b) 乙肝表面抗原(HBsAg)阴性;HBsAg 或乙肝核心抗体(HBcAb)阳性的情况下,HBV-DNA(HBV 脱氧核糖核酸)低于参考值范围下限;
c) 丙型肝炎病毒抗体(HCV-Ab)阴性。
12. 已怀孕或哺乳期的女性。
13. 存在严重的心理或精神异常,影响受试者参加本临床研究的依从性。
14. 筛选之前 3 个月内参加过任何临床试验。
15. 经研究者判断有其它不适于参与研究的情况。
研究者信息
1、主要研究者信息
姓名:沈琳
学位:医学博士
职称:主任医师
单位名称:北京大学肿瘤医院
2、各参加机构信息
| 序号 | 机构名称 | (主要)研究者 | 国家 | 省(州)-城市 |
| 1 | 北京大学肿瘤医院 | 沈琳 | 中国 | 北京市 -北京市 |
| 2 | 厦门大学附属第一医院 | 叶峰 | 中国 | 福建省 -厦门市 |





























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城