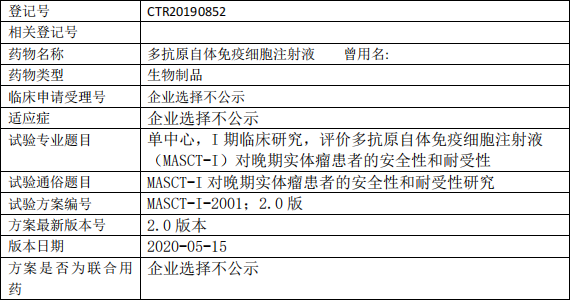
恒瑞源正MASCT-I临床试验,多抗原自体免疫细胞注射液MASCT-I对晚期实体瘤患者的安全性和耐受性的I期临床试验
1、试验目的
主要目的: MASCT-I 对晚期转移或复发且各种标准治疗失败的实体瘤患者的安全性和耐受性。
次要目的:MASCT-I 给药后的免疫响应。
探索性目的:初步探索MASCT-I 的疗效。
2、试验设计
试验分类:安全性和有效性
试验分期:I 期
设计类型:单臂试验
随机化:随机化
盲法:开放
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至 70 岁(最大年龄)
性别:男+女
健康受试者:无
入选标准
1.在进行任何方案有关的程序,包括筛选期的评估前,获得受试者/法定代表的书面知情同意;
2.病理学确诊的多种实体瘤,晚期转移或复发,且标准治疗失败后或不能耐受者,或缺乏有效的治疗方法的患者;
3.末次化疗结束后至少 4 周;
4.至少具有一个可测量的符合 RECISTv1.1 标准的可供评价的病灶;
5.美国东部肿瘤协作组(ECOG)体力状况评分为 0-1 分;
6.预计生存时间≥6 个月;
7.重要器官的功能符合下列要求(筛选前 14 天内不允许使用任何血液成分及细胞生长因子):
a)血红蛋白≥90g/L;b)白细胞≥3.0×109/L; c)中性粒细胞绝对计数(ANC)≥1.5×109/L;
d)血小板≥100×109/L;
e)ALT 和 AST ≤1.5 倍 ULN;对于有肝转移的病人或肝癌病人,ALT、AST≤5 倍正常上限值;
f)血清总胆红素<1.5 倍正常上限值;这一点不适用于确诊Gilbert’s 综合征(在缺乏溶血或肝病的证据下,持续或反复的高胆红素血症[主要是未结合胆红素])的病人,此类病人在咨询医生的情况下是允许的;
g)血清尿素氮和肌酐≤1.5 倍正常上限值或肌酐清除率≥50mL/min (应用标准的 Cockcroft-Gault 公式);h)血清白蛋白≥3.0g/dL。
排除标准
1.当前正在参与临床研究或接受研究治疗,或者治疗首次给药前4周内参与过试验性药物的研究或接受过研究治疗或使用过试验性器械。
注:已进入一种试验性研究随访期的受试者自前一种试验性药物或器械末次应用后 4 周可参与本研究;
2. 受试者在研究期间可能会接受其他全身抗肿瘤治疗
3. 终末期恶病质患者;
4. 严重凝血功能障碍者;
5. 怀孕或计划怀孕;
6. 已知对枸橼酸钠或人血白蛋白过敏者;
7. 受试者曾经接受过异体器官移植(包括骨髓移植和干细胞移植,但角膜移植除外);
8. 有未能良好控制的心脏临床症状或疾病,如:
(1)NYHA2 级以上心力衰竭
(2)不稳定型心绞痛
(3)1年内发生过心肌梗死
(4)有临床意义的室上性或室性心律失常需要治疗或干预的患者;
9. 先前接受放疗、激素治疗、手术或分子靶向治疗或免疫治疗,在治疗完成后,研究用药前不足 4 周的受试者;
10. 受试者有临床症状的中枢神经系统转移(如脑水肿、需要激素干预,或脑转移进展)。既往接受过脑或脑膜转移治疗,如临床稳定( MRI )已维持至少 2 个月,并且已经停止全身性激素治疗(剂量>10mg/天泼尼松或其他等疗效激素)大于 2 周的患者可以纳入;
11. 受试者正在使用免疫抑制剂、或全身、或可吸收的局部激素治疗以达到免疫抑制目的(剂量>10mg/天泼尼松或其他等疗效激素),并在入组前 2 周内仍在继续使用的,以下情况例外:
a)鼻内,吸入,局部使用类固醇,或局部类固醇注射(如关节内注射);
b)以生理剂量全身使用皮质类固醇,不超过10mg/天的泼尼松或它的等同物;
c)类固醇作为超敏反应的预防用药(如 CT 扫描提前用药)
12. 半年内曾系统性或较长期应用过免疫调节剂如干扰素、胸腺肽等和免疫抑制药物如肾上腺皮质激素类药物等;系统性或长期应用指免疫调节剂连续规范性用药 3 个月以上,免疫抑制药物连续规范性用药 1 个月以上;
13. 受试者既往一年内曾接受过 MASCT 或其它的细胞治疗;
14. 受试者存在任何活动性自身免疫病或有自身免疫病病史(如,但也不局限于:间质性肺炎,葡萄膜炎,肠炎,肝炎,垂体炎,血管炎,肾炎,甲状腺功能亢进,甲状腺功能降低;如受试者患有白癜风或在童年期哮喘已完全缓解,成人后无需任何干预的可纳入;受试者需要支气管扩张剂进行医学干预的哮喘则不能纳入);
15. 活动性结核病;
16. 在第一次研究治疗前 30 天内,有大的手术操作(根据研究者的定义);
17. 患有活动性乙肝病毒(HBV)感染(慢性或急性),定义为筛选期乙肝表面抗原(HBsAg)检测结果呈阳性,以下情况除外:对于既往 HBV 感染或 HBV 感染已治愈(定义为筛选时 HBsAg 检测结果阴性,而总乙肝病毒核心抗体[HBcAb]检测结果阳性)的患者,如果 HBV DNA 为阴性或不可检出,则可参与本项研究。此项标准不适用于肝癌患者;
18. 患有活动性丙肝病毒(HCV)感染,定义为筛选时,HCV 抗体检查呈阳性,且 HCV RNA 检查呈阳性;
19. 患有人类免疫缺陷病毒(HIV)或梅毒;
20. 受试者存在精神和认知障碍;
21. 受试者有活动性感染或在筛选期间、首次给药前发生原因不明发热>38.5 度(经研究者判断,受试者因肿瘤产生的发热可以入组);
22. 5 年内患有其他恶性肿瘤(已治愈的皮肤基底细胞癌和宫颈原位癌除外);
23. 受试者已知有精神类药物滥用、酗酒或吸毒史;
24. 经研究者判断,不适合入组者。
研究者信息
1、主要研究者信息
姓名:徐瑞华
学位:医学博士
职称:教授
单位名称:中山大学附属肿瘤医院
2、各参加机构信息
机构名称:中山大学附属肿瘤医院
(主要)研究者:徐瑞华
国家:中国
省(州)-城市:广东省 -广州市



























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城